Обґрунтування використання комбінованої спінально-епідуральної анестезії для знеболення при оперативних втручаннях з приводу пухлин черевної порожнини у дітей
Резюме. Дослідження проведено у 23 дітей, прооперованих з приводу пухлин заочеревинного простору, нирки, яєчника. Залежно від методики знеболення пацієнти були поділені на 2 групи: у 1-й групі використовували комбіновану спінально-епідуральну анальгезію (КСЕА) та безперервну внутрішньовенну інфузію фентанілу; в 2-й групі призначали лише внутрішньовенну безперервну інфузію фентанілу. Проведення мультимодальної анальгезії (КСЕА та безперервна внутрішньовенна інфузія опіоїдних анальгетиків) значно зменшує негативні наслідки недостатнього знеболення у дітей та сприяє ефективній анальгезії після травматичних операцій.

Вступ
На думку багатьох авторитетних дослідників, неадекватна та неефективна анальгезія в ранній післяопераційний період наявна у 30–50% хворих, при цьому найближчий післянаркозний період розглядається як слабка ланка анестезіологічного забезпечення [1, 2]. Неадекватна анальгезія в ранній післяопераційний період погіршує перебіг і прогноз одужання у дітей та збільшує смертність за рахунок підвищення ризику розвитку сепсису, післяопераційних ускладнень. Біль, який відчувала дитина, змінює розвиток системи ноцицепції і призводить до незворотних функціональних і структурних змін в центральній нервовій системі, чим змінює «програму» відповіді на біль у майбутньому [4–8, 10].
Серед основних причин неадекватної анальгезії в післяопераційний період у дітей відзначають: відсутність загальновизнаних і простих методів оцінки тяжкості больового синдрому в педіатрії; використання наркотичних анальгетиків рідко і в дозі, нижчій від необхідної для уникнення побічної дії; неможливість або обмеження використання ефективних сучасних методів післяопераційної анальгезії та переконання частини лікарів, що такі діти є менш чутливими до болю [3].
У структурі післяопераційного знеболення у дітей, як і в інших вікових групах, основне місце займають наркотичні анальгетики, шлях введення традиційний — внутрішньом’язовий [4].
Метою нашого дослідження було підвищення ефективності анестезіологічного забезпечення оперативних втручань з приводу пухлин черевної порожнини у дітей.
Об’єкт і методи дослідження
Дослідження проведено у 23 дітей (4,4±1,2 року), прооперованих з приводу пухлин заочеревинного простору (14 дітей, 61%), нирки (6 дітей, 26%), яєчника (3 дітей, 13%). Залежно від методики знеболення пацієнтів поділено на 2 групи: у 1-й групі (13 пацієнтів) використовували комбіновану спінально-епідуральну анальгезію (КСЕА) та безперервну внутрішньовенну інфузію фентанілу; у 2-й группі (10 дітей) призначали лише внутрішньовенну безперервну інфузію фентанілу [2–4]. Усім хворим проводили комплексне інтенсивне лікування: інфузійна та трансфузійна терапія, респіраторна підтримка апаратом «Hamillton C2» — режим ASV за параметрами (30% FiO2, PEEP 2 см H20, PIP 15–20 см H20), антибактеріальне лікування, посиндромна терапія. Оцінку ефективності знеболення в ранній післяопераційний період проводили за допомогою візуально-аналогової шкали (ВАШ) — Observation Scale for Infants and Small Children. Аналізували такі показники: частоту дихання, частоту серцевих скорочень (ЧСС), артеріальний тиск систолічний (АТсист), діастолічний (АТдіаст), середній АТ (САТ), сатурацію кисню (SaO2), концентрацію CO2 у повітрі, що видихається (CO2 ET), рівень кортизолу в крові, клініку перебігу анестезії. Додатково вивчали показники центральної гемодинаміки: ударний об’єм (УО), об’єм кровообігу за хвилину (ХОК). Реєстрація параметрів відбувалася в автоматичному режимі за допомогою моніторів «Datascope» та «Novometrix». Дослідження проводили на таких етапах знеболення: 1-й — початок оперативного втручання, 2-й — травматичний момент оперативного втручання, 3-й — закінчення оперативного втручання, 4-й — 6-та година після оперативного втручання та 5-й етап — 12-та година піcля оперативного втручання.
Статистичну обробку отриманих даних проводили із застосуванням методів варіаційної статистики за допомогою програми «Stаtistica 5.5» (належить ЦНІТ ВНМУ ім. М.І. Пирогова, ліцензійний № AXXR910A374605FA). Оцінювали та визначали середні значення, стандартні відхилення та похибки середнього. Вірогідність різниці значень між кількісними величинами в разі відповідності розподілів нормальному значенню визначали за допомогою критеріїв Стьюдента та Фішера. Вірогідними вважалися відмінності при р<0,05.
Результати та їх обговорення
У 1-й групі (13 пацієнтів) проводили знеболення методом КСЕА бупівакаїном 0,5% у дозі 0,3–0,4 мг/кг спінально-епідурально (середня доза 0,35±0,2 мг/кг) та безперервною внутрішньовенною інфузією фентанілу в дозі 10 мкг/кг/год (середня доза 10,1±0,2 мг/кг); у 10 дітей 2-ї групи застосовували знеболення безперервною внутрішньовенною інфузією фентанілу в дозі 10 мкг/кг/год (середня доза 10,5±0,3 мг/кг) [2–4]. КСЕА анестезію проводили за стандартною методикою — на рівні сегменту LI–LII пунктували епідуральний простір спеціальною двопросвітною голкою, загостреною за типом олівця (B. Braun, 18/27 G), потім в її просвіт вводили більш тонку та довгу спінальну голку і пунктували субарахноїдальний простір. Після отримання ліквору вводили бупівакаїн 0,5% в дозі 0,15–0,2 мг/кг. Епідуральний простір після видалення спінальної голки катетеризували в краніальному напрямку і вводили розраховану дозу [1, 7, 8]. Показаннями до введення
додаткових болюсів наркотичних анальгетиків були больова поведінка, десинхронізація зі штучною вентиляцією легень і тахікардія.
У 1-й групі була відсутня необхідність додаткового введення морфіну, у 2-й групі, навпаки, введено додаткові болюси морфіну (0,5 мг/кг) 4 (40%) дітям. Середня сума балів, яка характеризувала інтенсивність больового синдрому в ранній післяопераційний період на всіх етапах дослідження (за ВАШ), у хворих 1-ї групи була вірогідно меншою (р<0,05) за відповідний показник у 2-й групі (рис. 1).
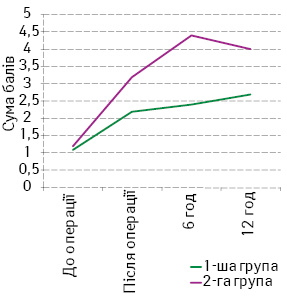
Аналіз ЧСС у дітей 1-ї групи виявив, що у більшості пацієнтів (11 дітей, 91,6%) середнє значення ЧСС за весь час інфузії фентанілу та проведення КСЕА становило 80 мм рт. ст., у 8 (80%) пацієнтів середнє значення систолічного АТ знаходилося в межах 67–78 мм рт. ст. Показники SaO2 під час усього дослідження у всіх дітей 1-ї та 2-ї груп залишалися стабільними у 98–99% випадків (таблиця).
Таблиця. Зміни показників гемодинаміки, пульсоксиметрії та капнометрії на етапах дослідження (M±m)
| Показники | Етап дослідження | ||||
| 1-й етап | 2-й етап | 3-й етап | 4-й етап | 5-й етап | |
| 1-ша група (внутрішньовенна інфузія фентанілу + КСЕА) | |||||
| ЧСС | 134,4±10,4 | 122,2±8,3* | 120,4±9,2* | 130,3±10,3* | 134,4±13,2* |
| АТсист | 72,1±1,3 | 72,2±1,2 | 71,3±1,6 | 70,3±1,2 | 69,3±1,2 |
| АТдіаст | 43,3±1,4 | 40,3±1,4 | 39,4±1,6 | 42,2±1,3 | 44,4±1,4 |
| SaO2 | 96,1±0,4 | 97,4±0,2* | 97,2±1,4 | 98,4±0,2 | 98,2±1,4 |
| УО, мл | 10,2 ±1,1 | 10,4±1,2 | 10,8±1,3 | 10,8±1,1 | 10,3±1,2 |
| ХОК, л | 1,7 ±0,2 | 1,8±0,2* | 1,8±0,1* | 1,3±0,2 | 1,4±0,4 |
| CO2 ET | 37,4±1,2 | 37,0±1,2 | 38,0±1,1 | 36,1±1,1 | 38,2±0,9 |
| 2-га група (внутрішньовенна інфузія фентанілу 10 мкг/кг/год) | |||||
| ЧСС | 136,4±7,4 | 152,3±8,2 | 140,2±10,1 | 150,4±7,3 | 142,3±6,2 |
| АТсист | 71,4±1,4 | 74,2±1,4 | 73,3±1,4 | 76,4±1,2 | 74,2±1,3 |
| АТдіаст | 42,3±1,3 | 40,3±1,3 | 42,6±1,4 | 42,4±1,4 | 41,4±1,2 |
| SaO2 | 96,2 ±0,1 | 96,2±0,1 | 95,8±0,2 | 98,1 ±0,1 | 98,0±0,2 |
| УО, мл | 10,3±2,1 | 10,2±1,9 | 10,6±2,0 | 11,0±1,2 | 10,5±1,4 |
| ХОК, л | 1,6±0,2 | 1,2±0,1 | 1,2±0,2 | 1,4±0,2 | 1,3±0,3 |
| CO2 ET | 37,4±0,8 | 36,8±1,2 | 37,8±1,4 | 35,8±1,2 | 38,4±1,0 |
Примітка: *p<0,05 при порівнянні знеболення в 1-й та 2-й групах
Тривалу тахікардію реєстрували у 2 (15,3%) дітей 1-ї групи, при цьому лише у однієї дитини вона була пов’язана з больовим синдромом. У більшості пацієнтів тахікардію констатували з моменту поступлення у відділення із операційної, що було пов’язано з гіповолемією, інтоксикацією, можливо, з недостатньою інтраопераційною анальгезією. Тахікардія зникала при проведенні інфузійної терапії. Вірогідне зниження на останніх етапах дослідження середніх значень ЧСС і АТ у пацієнтів 1-ї групи може свідчити про ліквідацію гемодинамічних змін, які пов’язані з основним захворюванням і операцією, та про досягнення необхідного рівня анальгезії і седації. Ізольовані гемодинамічні зміни, які свідчать про больовий синдром, трапляються досить рідко. У більшості випадків вони є короткотривалими та виникають у відповідь на збільшення фізичного навантаження при реакції больової поведінки. Відомо, що рівень кортизолу є одним із показників стресової реакції, в тому числі й больової. Динаміку рівня кортизолу в крові в післяопераційний період продемонстровано на рис. 2.
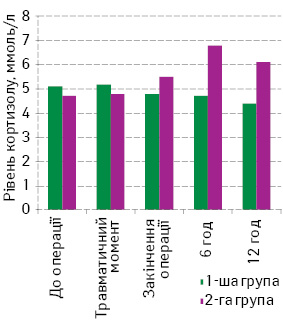
Динаміка рівня кортизолу в крові в 1-й групі свідчить про ліквідацію у більшості дітей протягом перших 12–24 год після операції тяжкого стресу, виникнення якого пов’язано з основним захворюванням або операцією і достатньою анальгезією після операції.
Таким чином, ефективність використання КСЕА та безперервної інфузії фентанілу ґрунтується на можливості впливу на різні механізми виникнення болю — на центральний (наркотичні анальгетики) і периферичний (КСЕА) [9]. Проведення КСЕА дозволяє значно знизити потребу в опіоїдах, а їх комбінування може відновити анальгезивний потенціал останніх. Різні механізми дії цих препаратів дозволяють призначати їх у комбінації і в низьких дозах з метою досягнення значного анальгезивного ефекту.
Висновки
Комплексне вивчення реакцій больової поведінки, фізіологічних показників і лабораторних стресових тестів показало, що використання схеми КСЕА бупівакаїном 0,3–0,4 мг/кг та методу постійної внутрішньовенної інфузії препаратів (фентаніл в дозі 10 мкг/кг/год) для післяопераційного знеболення призводить до ефективної анальгезії після травматичних операцій.
Проведення комбінованої анальгезії (КСЕА та безперервна внутрішньовенна інфузія опіоїдних анальгетиків) значно зменшує негативні наслідки недостатнього знеболення у дітей, прооперованих з приводу пухлин черевної порожнини, тому можливе її застосування для ведення пацієнта в післяопераційний період.
Список використаної літератури
1. Айзенберг В.Л., Ульрих Г.Э., Цыпин Л.Е., Заболотский Д.В. (2012) Региональная анестезия в педиатрии. Синтез Бук.: 304 с.
2. Ветешев П.С., Ветешева М.С. (2002) Принципы анальгезии в раннем послеоперационном периоде. Хирургия, 12: 49–52.
3. Лекманов А.У. (1999) Внутривенное использование трамадола для послеоперационной анальгезии у детей. Материалы VIII Всероссийского съезда анестезиологов реаниматологов: 14–17.
4. Осипова Н.А., Никода В.В. (2003) Современное состояние науки о боли. Острые и хронические болевые синдромы. Анестезиология и реаниматология, 5: 4–9.
5. Морган-мл. Дж.Э., Мэгид С. Михаил (2003) Клиническая анестезиология. Бином, Москва, 3: 298.
6. Караваева С.А., Баиров В.Г., Немилова Т.К. (1998) Лечение гастрошизиса. Детская хирургия, 3: 4–7.
7. Zoric S., Stamenkovic D., Stevanovic S. et al. (2003) Combined spinal epidural and general anesthesia in abdominal surgery. Med. Arh., 57 (4): 21–28.
8. Kopacz D.J., Allen H.W., Thompson G.E. (2000) A comparison of epidural levobupivacaine 0.75% with racemic bupivacaine for lower abdominal surgery. Anesth. Analg., 90: 642–648.
9. Brennum J., Petersen K.L., Horn A. et al. (1994) Quantitative sensory examination of epidural anaesthesia and analgesia in man: combination of morphine and bupivacaine. Pain, 56: 327–337.
10. Hopf H., Weitz J. (1994) Postoperative pain management. Arch. Surg., 129(2): 128–132.
Обоснование использования комбинированной спинально-эпидуральной анестезии для обезболивания при оперативных вмешательствах по поводу опухолей брюшной полости у детей
Резюме. Исследования проведены у 23 детей, прооперированных по поводу опухолей забрюшинного пространства, почки и яичника. В зависимости от методики обезболивания пациенты были поделены на 2 группы: в 1-й группе использовали комбинированную спинально-эпидуральную анальгезию (КСЭА) и постоянную внутривенную инфузию фентанила, во 2-й группе назначали только внутривенную постоянную инфузию фентанила. Проведение мультимодальной анальгезии (КСЭА и постоянная внутривенная инфузия опиоидных анальгетиков) значительно уменьшает негативные последствия недостаточного обезболивания у детей и способствует эффективной анальгезии после травматических операций.
комбинированная спинально-эпидуральная анестезия, ненаркотические анальгетики, опухоли брюшной полости.














Leave a comment