Прогностична значущість простатичної інтраепітеліальної неоплазії високого ступеня
Литвиненко Р.А., Вітрук Ю.В., Стаховський О.Е.
Резюме. Рак передміхурової залози (РПЗ) становить значну проблему в системі охорони здоров’я в усьому світі. Точне виявлення ранніх форм РПЗ, а також пов’язаних із ним передракових станів є, безперечно, необхідним. Простатична інтраепітеліальна неоплазія (ПІН) — передраковий стан, який характеризується структурно доброякісними залозами і протоками, встеленими атиповими клітинами, без анатомічного розповсюдження за межі капсули, що підтверджує суть цього передракового ураження тканини передміхурової залози. Більшість пухлин діагностують при першій повторній біопсії з вищою стадією, ступенем і більшим об’ємом, і такі пацієнти, очевидно, виграють від цього втручання, порівняно з хворими з консервативним веденням. У представленому огляді проаналізовано сучасні дані про зв’язок між ПІН високого ступеня і РПЗ. Встановлено, що у пацієнтів із вихідним діагнозом ізольованої ПІН високого ступеня повторну біопсію слід вважати обов’язковою. Для вирішення проблеми оптимального ведення хворих із локалізованими формами хвороби та стану якості їх життя після хірургічного втручання з приводу РПЗ необхідні великі проспективні дослідження з тривалішим періодом спостереження.
Незважаючи на зусилля, спрямовані на діагностику та лікування раку передміхурової залози (РПЗ), питання оптимального ведення хворих із локалізованими формами, виявлення патології в ранній стадії та належної якості життя після хірургічного втручання з приводу РПЗ залишаються невирішеними. РПЗ становить значну проблему в системі охорони здоров’я в усьому світі [12]. РПЗ є злоякісною пухлиною, яку діагностують з найвищою частотою, і другою найбільш поширеною причиною смерті від онкологічних захворювань серед чоловічого населення у Сполучених Штатах Америки, а поступається лише раку легені [4, 23]. Крім того, середня тривалість життя чоловіків, що поступово збільшується в розвинених країнах світу, може призвести до відповідного підвищення рівня виявлення випадків клінічно значущого РПЗ. Згідно з даними літератури, у Великобританії щорічно більшість із 35 тис. діагнозів РПЗ уперше встановлюють у результаті трансректальної біопсії передміхурової залози під ультразвуковим контролем з приводу підвищеного рівня простатспецифічного антигену (ПСА) або підозри на новоутворення після проведення пальцевого ректального дослідження [19, 38]. Підвищений рівень ПСА або підозра на рак, що виникли при ректальному дослідженні, потребують біопсії передміхурової залози [18]. У пацієнтів із негативними результатами ініціальної біопсії рівень виявлення РПЗ при повторній біопсії коливається від 10 до 20% [32]. Таким чином, точне виявлення ранніх форм РПЗ, а також пов’язаних із ним передракових станів є, безперечно, необхідним.
Простатична інтраепітеліальна неоплазія (ПІН) — неопластична проліферація епітеліальних клітин протоків та ацинусів передміхурової залози [52]. Розрізняють ПІН низької та високої градації. Нині ПІН низької градації не підлягає документуванню як окремий діагноз, оскільки вона характеризується незначною атипією, котру важко відрізнити від нормальних і гіперпластичних залоз [21]. Частота виявлення ПІН високого ступеня становить 0,6–24,6% при ініціальній біопсії [20, 21, 43]. ПІН високого ступеня є передраковим станом і характеризується структурно доброякісними залозами і протоками, встеленими атиповими клітинами, без анатомічного розповсюдження за межі капсули, що підтверджує суть цього ураження тканини передміхурової залози [15, 44]. На відміну від аденокарциноми, залози з ознаками ПІН містять шар базальних клітин по периферії [6, 13, 39]. Гістологічні характеристики ПІН високого ступеня подано в табл. 1.
Таблиця 1. ПІН високого ступеня: діагностичні критерії за Bostwick [18]
| ПІН високого ступеня | |
| Архітектура | Епітеліальні клітини заповнюють простір нерівномірно, відзначають більше скупчення клітин, порівняно з ПІН низького ступеня; розподіляється за будовою на 4 види: пучкоподібну, мікропапілярну, плоску та внутрішньопротокову |
| Цитологія | |
|
Збільшені; деякі з них різних розмірів та форм |
|
Підвищені щільність і злипання |
|
Трапляються великі та гарно помітні, схожі на такі при інвазивній карциномі; іноді множинні |
| Шар базальних клітин | Переривчастими рядками розташовані на базальній мембрані |
| Базальна мембрана | Незадіяна |
ПІН високого ступеня є передвісником РПЗ, проте не супроводжується підвищенням ПСА в сироватці крові, не визначається при виконанні трансректального ультразвукового обстеження (ТРУЗО), а лише характеризується морфологічними відмінностями від РПЗ [8, 30, 49].
У низці патоморфологічних досліджень встановлено, що запальні інфільтрати в тканині передміхурової залози можуть призводити до фокальної атрофії епітелію, де в результаті запального пошкодження розвивається регенераторна проліферація [1–3, 50]. Враховуючи те, що гени, відповідальні за супресію пухлинного росту, є пригніченими в ділянках фокальної епітеліальної атрофії, можливою стає ініціація розвитку диспластичних і проліферативних змін [11, 14]. Таким чином, у результаті розвитку проліферативної запальної атрофії підвищується ризик розвитку ПІН, що робить передміхурову залозу більш вразливою для виникнення неопластичного процесу (рис. 1–4).
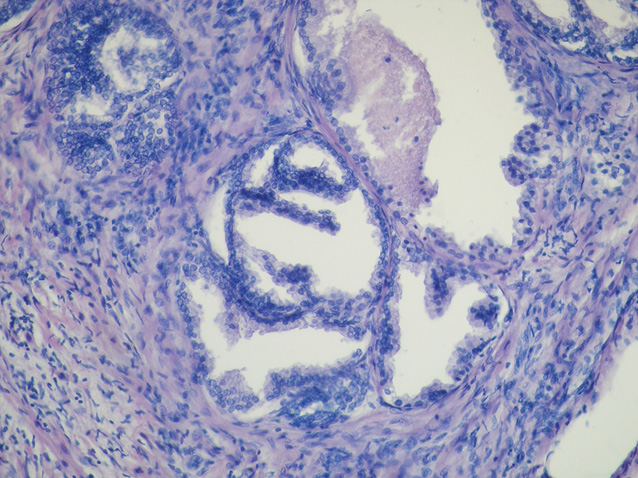
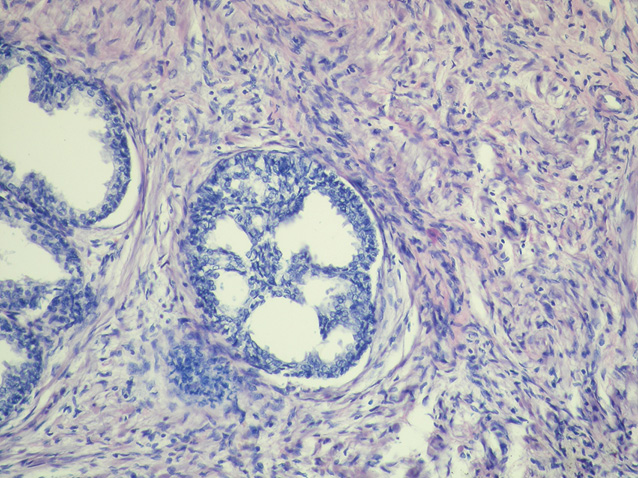
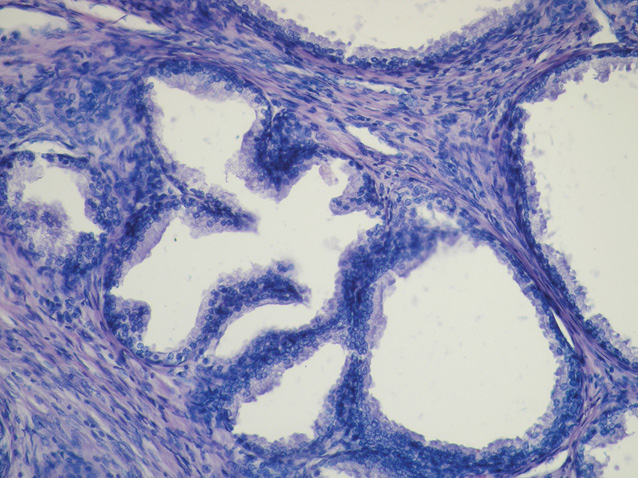
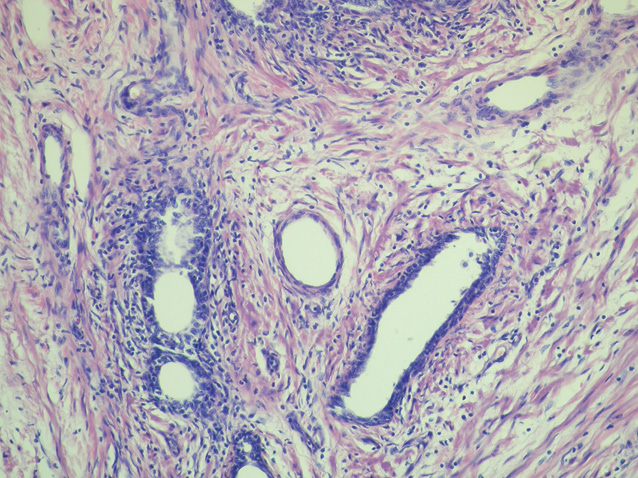
У табл. 2 представлено поширеність ПІН для чоловічого населення, за даними досліджень у різних популяціях. Найнижчий рівень виявлення ПІН встановлено в чоловіків, які брали участь у скринінгу з визначенням ПСА для раннього виявлення РПЗ. Поширеність ПІН, зафіксована при біопсії, становила 0,7–20%. У сучасних практичних дослідженнях ПІН при біопсії виявляють у 4,4–25% випадків.
Таблиця 2. Поширеність ПІН високого ступеня при біопсії передміхурової залози
| Джерела | Досліджувані популяції | Чоловіки, n | Поширеність, % |
| Скринінгові програми | |||
| Mettlin et al., 1991 [40] | Американська національна організація з дослідження раку. Проект із детекції РПЗ | 330 | 5,2 |
| Feneley et al., 1997 [24] | Скринінг населення у Гвенті, Англія, 1991–1993 рр. | 212 | 20 |
| Hoedemaeker et al., 1999 [28] | Скринінг ПСА у Роттердамі, Нідерланди | 1824 | 0,7 |
| Урологічна практика | |||
| Lee et al., 1989 [35] | Повторні біопсії з приводу виявлених гіпоехогенних структур при ТРУЗО. Госпіталь милосердя святого Жозефа | 256 | 11 |
| Bostwick et al., 1995 [9] | Повторні біопсії у Клініці Мейо, Рочестер,Міннесота | 200 | 16,5 |
| Bostwick et al., 1995 [9] | Повторні біопсії у клініці Глендейла, Каліфорнія | 200 | 10,5 |
| Langer et al., 1996 [34] | Повторні біопсії у медичному центрі Університету Пенсильванії, Філадельфія | 1275 | 4,4 |
| Wills et al., 1997 [51] | Повторні біопсії у Госпіталі Джона Хопкінса, Балтимор, Меріленд | 439 | 5,5 |
| Feneley et al., 1997 [22] | Повторні біопсії у Госпіталі Університетського коледжу в Лондоні, 1988–1994 рр. | 1205 | 11 |
| O’Dowd et al., 2000 [42] | Повторні біопсії у «UroCor Labs», Оклахома, 1994–1998 рр. | 132, 426 | 2,3 |
| Fowler et al., 2001 [24] | Повторні біопсії у чоловіків з підозрою на карциному в «Veterans Affairs Medical Center»,Міссісіпі, 1992–1998 | 1050 | 8,9 |
Клінічна важливість ПІН базується на її тісному зв’язку з РПЗ, тому її ідентифікація при біопсії виправдовує подальший пошук симультантного інвазивного раку. Наступні біопсії проводять через 3 та 6 міс протягом 2 років, а потім — через 12 міс. Якщо за результатами дослідження неможливо ідентифікувати супутню карциному, рекомендують активне спостереження, оскільки з прогресуванням ПІН високого ступеня підвищується ймовірність пошкодження базального шару клітин і переходу в інвазивну форму [7].
Захворюваність на РПЗ, виявлена після встановлення діагнозу ПІН високого ступеня, знизилася за останні 2 десятиріччя [20, 41, 48]. У більш ранніх дослідженнях частота виявлення РПЗ сягала 27–79%, тоді як зовсім недавно в середньому наближалася до 25% [20, 42]. Хоча це зниження зумовлено відсіюванням артефактів, що виникали при використанні розширених протоколів біопсії, ПІН високого ступеня та РПЗ мали багато схожих характеристик. Як і РПЗ, ПІН високого ступеня здебільшого мультифокальні, їх виявляли в основному в периферичній зоні передміхурової залози [10]. ПІН високого ступеня часто розміщені у безпосередній близькості від інвазивних ракових клітин, однак збільшення поширеності залежно від віку відстає від РПЗ приблизно на 5 років [10, 33]. Багато урологів вважають, що у пацієнтів із виявленою ізольованою ПІН високого ступеня вищий ризик розвитку РПЗ, незалежно від їх віку та рівня ПСА, і рекомендують обов’язкові повторні біопсії. Залишається дискутивним питання інтервалу часу, через який необхідно проводити повторну біопсію [26].
Карциноми, виявлені при першій або другій повторній біопсії передміхурової залози після негативного результату ініціальної біопсії у пацієнтів із підвищеним рівнем ПСА, часто є клінічно значущими [17]. При подальших біопсіях з’являється можливість діагностувати рак меншого обсягу, нижчої градації з сумнівною значимістю. Як правило, за відсутності інших клінічних проявів у більшості випадків їх не рекомендують [25]. Знаходять небагато відмінностей в характеристиках пухлини, які виявляють при послідовних дослідженнях після початкового діагнозу ізольованої ПІН високого ступеня [15, 17]. Залишаються актуальними питання: скільки потрібно провести повторних біопсій для ПІН високого ступеня? Чи варто шукати ці пухлини і чи є вони клінічно значущими?
Клінічну значущість РПЗ визначають на основі критеріїв Епштейна [36], які включають:
- щільність ПСА
- бали за Глісоном ≤6 при біопсії;
- наявність пухлини в двох або менше ядрах;
- не більше 50% залучення в пухлину одного ядра [46].
Точність критеріїв Епштейна щодо клінічної значущості останнім часом під сумнівом. Деякі дослідники повідомляли про те, що оцінка за Епштейном призводить до встановлення неправильного діагнозу; частина таких авторів стверджують, що розбіжність такої оцінки з післяопераційним діагнозом становить майже 24% [29]. В огляді даних 6496 пацієнтів, які перенесли РПЕ, середній період спостереження дорівнював 9,2 року. Група дослідників Клініки Мейо відзначила, що «незначущий» РПЗ, згідно з критеріями Епштейна, мав зіставний ризик біохімічного прогресування, порівняно з низьким ступенем «значущого» РПЗ [5, 29]. Очевидно, що критерії Епштейна мають свої обмеження, тому у виборі лікувальної тактики не можна керуватися виключно ними.
ПІН високого ступеня є чітко визначеною гістологічною одиницею, яку, за сучасними даними літератури, ідентифікують як передраковий стан. Незважаючи на це, точиться ще багато суперечок навколо точного клінічного значення та найбільш коректного ведення хворих з ізольованою ПІН високого ступеня. Сучасні імуногістохімічні методи не здатні надійно визначити, у якого пацієнта ізольована ПІН високого ступеня буде прогресувати в інвазивний РПЗ.
Частота виявлення РПЗ при повторній біопсії після ідентифікації ПІН високого ступеня знизилася за останні кілька декад приблизно до 24,1%, причому багато дослідників підкреслили, що це значення збігається з частотою РПЗ, визначеною у пацієнтів при повторній біопсії після ініціальної негативної біопсії, виконаної з приводу підвищеного рівня ПСА [20, 41, 47]. Це зниження поширеності в основному пов’язане з частішим використанням розширеної біопсії передміхурової залози (≥10 точок), у результаті чого багато пухлин, які були б діагностовані при повторній біопсії для ПІН високого ступеня, виявляють при первинній [20, 27, 30, 41, 48].
Необхідно підкреслити, що, крім наявності ізольованої ПІН високого ступеня, ряд інших незалежних факторів можуть підвищити ймовірність виявлення РПЗ у повторних біоптатах, серед них – збільшення інтервалу між біопсіями, віку пацієнта, підвищення рівня ПСА і підтвердження мультифокальності ПІН високого ступеня [30]. G. Raviv та співавтори оприлюднили дані про частоту 33 і 62% при ПСА10 нг/мл відповідно [45]. Крім того, результати сучасних досліджень свідчать про те, що іонізуюче випромінювання, призначення гормональнальних препаратів та харчові фактори також можуть вплинути на походження ПІН високого ступеня [30, 31]. Хоча наявність інтраепітеліальної неоплазії передміхурової залози є фактором високого ризику, залишається нез’ясованим, чи є об’єм ПІН високого ступеня, кількість біопсій з виявленням ізольованої ПІН високого ступеня та її гістологічні характеристики передвісниками виявлення РПЗ при наступних біопсіях.
У дослідженні J.I. Epstein і M. Herawi зазначено, що повторні біопсії протягом першого року після встановлення діагнозу ПІН високого ступеня є невиправданими за відсутності інших клінічних проявів РПЗ [20]. Однак R. Montironi та співавтори рекомендують виконати повторну біопсію протягом 6 міс після первинної біопсії, незалежно від результатів ректального дослідження і рівня ПСА, з подальшими біопсіями через кожні 6 міс протягом 2 років, а далі – 1 раз на рік [41].
S. Joniau та співавтори стверджували, що інтервал між повторними біопсіями має залежати від початкової кількості досліджених ядер, але врешті дійшли висновку, що для підтвердження такого підходу необхідні великі проспективні дослідження [30].
Висловлено припущення, що РПЗ, ідентифікований після декількох біопсій, імовірно, є неактивним за своєю природою. B. Djavan та співавтори виявили, що після початкового доброякісного діагнозу РПЗ, виявлений при повторних другій і третій біопсіях, мав нижчі градацію та стадію і менший об’єм, порівняно з тими, які діагностували при ініціальній та першій повторній біопсії [16]. Характеристики пухлини, виявленої при ініціальній та першій повторній біопсії, були подібними [17, 37, 48].
Отже, сучасні дані літератури свідчать про зв’язок між ПІН високого ступеня і РПЗ, а також потенціалом до злоякісної трансформації у подальшому. У пацієнтів з вихідним діагнозом ізольованої ПІН високого ступеня слід вважати повторну біопсію обов’язковою, особливо у тих, котрим не проведено розширеної біопсії. Більшість пухлин діагностують при першій повторній біопсії з вищими стадією та ступенем і більшим об’ємом, і такі пацієнти, очевидно, виграють від втручання, порівняно з хворими з консервативним веденням.
Крім того, половина пухлин, виявлених після другої повторної біопсії, можуть бути класифіковані як клінічно незначущі. При подальших біопсіях, імовірно, діагностуватимуть злоякісні новоутворення з нижчими градацією, стадією та меншим об’ємом. Це має серйозні наслідки для пацієнтів щодо показань до терапії та ризику необґрунтованого лікування. Отже, рішення провести другу повторну біопсію має бути автоматичним, але прийнятим з огляду на інші клінічні критерії. Подальших біопсій бажано уникати за відсутності чіткої клінічної підозри на РПЗ. Терміни повторної біопсії для ізольованої ПІН високого ступеня, як і раніше, залишаються суперечливими, і пацієнт має покладатися на досвід і знання лікаря.
Великі проспективні дослідження з тривалішим періодом мають на меті допомогти обрати найбільш адекватний режим для пацієнтів з ПІН високого ступеня.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Возіанов O.Ф., Пасєчніков С.П., Грицай В.С. та ін. (2010) Патоморфологічні особливості хронічного простатиту у хворих на доброякісну гіперплазію передміхурової залози, ускладнену гострою затримкою сечі. Здоровье мужчины, 3(34): 147–150.
2. Стаховский Э.А., Билык В.И, Войленко О.А., Котов В.А. (2001) Диагностика доброкачественной гиперплазии предстательной железы. Журнал практичного лікаря, 6: 29–31.
3. Чекалова А.О., Благодаров В.М., Романенко А.М., Піркко Харконен (2010) Хронічний атиповий проліферативний простатит, що розвивається під впливом довгострокової дії малих доз іонізуючого опромінення після аварії на ЧАЕС. Патологія, 2: 59–62.
4. Albany C., Alva A.S., Aparicio A.M. et al. (2011) Costantine Albany Epigenetics in prostate cancer. Prostate cancer, 12: 1–12.
5. Bostwick D.G. (1993) Architectural patterns of high grade prostatic intraepithelial neoplasia. Hum. Pathol., 24: 298–310.
6. Bostwick D.G., Brawer M.K. (1987) Prostatic intra-epithelial neoplasia and early invasion in prostate cancer. Cancer, 59: 788–794.
7. Bostwick D.G., Liu L., Brawer M.K., Qian J. (2004) High-grade prostatic intraepithelial neoplasia. Rev. Urol., 6(4): 171–179.
8. Bostwick D.G., Qian J. (2004) High-grade prostatic intraepithelial neoplasia. Mod. Pathol., 17: 360–379.
9. Bostwick D.G., Qian J., Frankel K. (1995) The incidence of high grade prostatic intraepithelial neoplasia in needle biopsies. J. Urol., 154: 1791–1794.
10. Brawer M.K. (2005) Prostatic intraepithelial neoplasia: an overview. Rev. Urol., 7(3): S11–S18.
11. Chan T.Y., Epstein J.I. (1999) Follow-up of atypical prostate needle biopsies suspicious for cancer. Urology, 53(2): 351–355.
12. Dall’Era M.A., Albertsen P.C., Bangma C. et al. (2012) Active surveillance for prostate cancer: A systematic review of the literature. Eur. Urol., 6: 976–983.
13. Davidson D., Bostwick D.G., Qian J. et al. (1995)Prostatic intraepithelial neoplasia is a risk factor for adenocarcinoma: Predictive accuracy in needle biopsies. J. Urol., 154: 1295–1299.
14. De Marzo A.M., Nakai Y., Nelson W.G. (2007) Inflammation, atrophy, and prostate carcinogenesis. Urol. Oncol., 25: 398–400.
15. De Marzo A.M., Nakai Y., Nelson W.G. et al. (2003) Pathological and molecular aspects of prostate cancer. Lancet, 361: 955–964.
16. Djavan B., Fong Y.K., Ravery V. et al. (2005) Are repeat biopsies required in men with PSA levels ≤ 4 ng/ml? A multiinstitutional prospective european study. Eur. Urol., 47: 38–44.
17. Djavan B., Ravery V., Zlotta A. et al. (2001) Prospective evaluation of prostate cancer detected on biopsies 1, 2, 3 and 4: when should we stop? J. Urol., 166: 1679–1683.
18. Djavan B., Zlotta A.R., Ekane S. et al. (2000) Is one set of sextant biopsies enough to rule out prostate Cancer? Influence of transition and total prostate volumes on prostate cancer yield. Eur. Urol., 38: 218–224.
19. Eggener S.E., Roehl K.A., Catalona W.J. (2005) Predictors of subsequent prostate cancer in men with a prostate specific antigen of 2.6 to 4.0 ng/ml and an initially negative biopsy. J. Urol., 174(2): 500–504.
20. Epstein J.I., Herawi M. (2006) Prostate needle biopsies containing prostatic intraepithelial neoplasia or atypical foci suspicious for carcinoma: implications for patient care. J. Urol., 175: 820–834.
21. Epstein J.I., Potter S.R. (2001) The pathological interpretation and significance of prostate needle biopsy findings: implications and current controversies. J. Urol., 166: 402–410.
22. Feneley M.R., Green J.S., Young M.P. et al. (1997) Prevalence of prostatic intra-epithelial neoplasia (PIN) in biopsies from hospital practice and pilot screening: clinical implications. Prostate Cancer Prostatic Dis., 1: 79-83.
23. Ferlay J., Autier P., Boniol M. et al. (2007) Estimates of the cancer incidence and mortality in Europe in 2006. Ann. Oncol., 18: 581–592.
24. Fowler J.E. Jr., Bigler S.A., Lynch C. et al. (2001) Prospective study of correlations between biopsy-detected high grade prostatic intraepithelial neoplasia, serum prostate specific antigen concentration, and race. Cancer, 91: 1291–1296.
25. Hara R., Jo Y., Fujii T. et al. (2008) Optimal approach for prostate cancer detection as initial biopsy: prospective randomized study comparing transperineal versus transrectal systematic 12-core biopsy. Urology, 71: 191–195.
26. Hendrik Van Poppel, Steven Joniau (2008) An analysis of radical prostatectomy in advanced stage and high-grade prostate cancer. Eur. Urol., 53: 253–259.
27. Herawi M., Kahane H., Cavallo C., Epstein J.I. (2006) Risk of prostate cancer on first re-biopsy within 1 year following a diagnosis of high grade prostatic intraepithelial neoplasia is related to the number of cores sampled. J. Urol., 175: 121–124.
28. Hoedemaeker R.F., Kranse R,. Rietbergen J.B. et al. (1999) Evaluation of prostate needle biopsies in a population-based screening study: the impact of borderline lesions. Cancer, 85: 145–152.
29. Jeldres C., Suardi N., Walz J. et al. (2008) Validation of the contemporary Epstein criteria for insignificant prostate cancer in European men. Eur. Urol., 54(6): 1306–1313.
30. Joniau S., Goeman L., Pennings J., Van Poppel H. (2005) Prostatic intraepithelial neoplasia (PIN): importance and clinical management. Eur. Urol., 48: 379–385.
31. Joniau S., Goeman L., Roskams T. et al. (2007) Effect of nutritional supplement challenge in patients with isolated high-grade prostatic intraepithelial neoplasia. Urology, 69: 1102–1106.
32. Koca O., Çalışkan S., Öztürk M.I. et al. (2011) Orhan Koca. Significance of atypical small acinar proliferation and high-grade prostatic intraepithelial neoplasia in prostate biopsy. Korean J. Urol., 52: 736–740.
33. Kovi J., Mostofi F.K., Heshmat M.Y. (1988) Large acinar atypical hyperplasia and carcinoma of the prostate. Cancer, 61: 555–561.
34. Langer J.E., Rovner E.S., Coleman B.G. et al. (1996) Strategy for repeat biopsy of patients with prostatic intraepithelial neoplasia detected by prostate needle biopsy. J. Urol., 155: 228–231.
35. Lee F., Torp-Pedersen S.T., Carroll J.T. et al. (1989) Use of transrectal ultrasound and prostate-specific antigen in diagnosis of prostatic intraepithelial neoplasia. Urology, 34(6): 4–8.
36. Lee M.C., Dong F., Stephenson A.J. et al. (2010) The Epstein Criteria Predict for Organ-Confined But Not Insignificant Disease and a High Likelihood of Cure at Radical Prostatectomy. Eur. Urol., 58: 90–95.
37. Lopez-Corona E., Ohori M., Wheeler T.M. et al. (2006) Prostate cancer diagnosed after repeat biopsies have a favorable pathological outcome but similar recurrence rate. J. Urol., 175: 923–928.
38. Rochester M.A., Pashayan N., Matthews F. et al. (2009) Development and validation of risk score for predicting positive repeat prostate biopsy in patients with a previous negative biopsy in a UK population. BMC Urology, 9: 7.
39. McNeal J.E., Bostwick D.G. (1986) Intraductal dysplasia: a premalignant lesion of the prostate. Hum. Pathol., 17: 64–71.
40. Mettlin C., Lee F., Drago J., Murphy G.P. (1991) The American Cancer Society National ProstateCancer Detection Project. Findings on the detection of early prostate cancer in 2425 men. Cancer, 67: 2949–2958.
41. Montironi R., Mazzucchelli R., Lopez-Beltran A. et al. (2007) Mechanisms of disease: high-grade prostatic intraepithelial neoplasia and other proposed preneoplastic lesions in the prostate. NCPUro; 4: 321–332.
42. O’Dowd G.J., Miller M.C., Orozco R., Veltri R.W. (2000) Analysis of repeated biopsy results within 1 year after a noncancer diagnosis. Urology, 55: 553–559.
43. Orozco R., O’Dowd G.J., Kunnel B. et al. (1998) Observations on pathology trends in 62,537 protstate biopsies obtained from urology private practices in the United States. Urology, 51: 186–219.
44. Park S., Meng M.V., Elkin E.P. et al. (2005) Androgen deprivation use with external beam radiation for prostate cancer: results from CaPSURE. J. Urol., 174(5): 1802–1807.
45. Raviv G., Zlotta A.R., Janssen T.H. et al. (1996) Does prostate-specific antigen and prostate-specific antigen density enhance the detection of prostate cancer in patients initially diagnosed to have prostatic intraepithelial neoplasia? Cancer, 77: 2103–2108.
46. Reese A.C., Landis P., Han M. et al. (2013) Expanded Criteria to Identify Men Eligible for Active Surveillance of Low-Risk Prostate Cancer at Johns Hopkins: A Preliminary Analysis. J. Urol., 190(6): 2033–2038.
47. Schlesinger C., Bostwick D., Iczkowski K. (2005) High-grade prostatic intraepithelial neoplasia and atypical small acinar proliferation: predictive value for cancer in current practice. Am. J. Surg. Pathol., 29: 1201–1207.
48. Sengupta S., Blute M.L., Bagniewski S.M. et al. (2008) After radical retropubic prostatectomy «insignificant» prostate cancer has a risk of progression similar to low-risk «significant» cancer. BJU Int., 101: 170–174.
49. Singh P.B., Nicholson C.M., Ragavan N. et al. (2009) Risk of prostate cancer after detection of isolated high-grade prostatic intraepithelial neoplasia (HGPIN) on extended core needle biopsy: a UK hospital experience. BMC Urology, 9: 3.
50. Thomas D., Kruslin B., Rogatsch H. et al. (2007) Different types of atrophy in the prostate with and without adenocarcinoma. Eur. Urol., 51: 98–104.
51. Wills M.L., Hamper U.M., Partin A.W., Epstein J.I. (1997) Incidence of high-grade prostatic intraepithelial neoplasia in sextant needle biopsy specimens. Urology, 49: 367–373.
52. Zynger D.L., Yang X. (2009) High-grade Prostatic Intraepithelial Neoplasia of the Prostate: The Precursor Lesion of Prostate Cancer. Int. J. Clin. Exp. Pathol., 2: 327–338.
Прогностическая значимость простатической интраэпителиальной неоплазии высокой степени
Резюме. Рак предстательной железы (РПЖ) является значительной проблемой в системе здравоохранения во всем мире. Точное выявления ранних форм РПЖ, а также связанных с ним предраковых состояний является, бесспорно, необходимым. Простатическая интраэпителиальная неоплазия (ПИН) — предраковое состояние, которое характеризуется структурно доброкачественными железами и протоками, устланными атипичными клетками, без анатомического распространения за пределы капсулы, что подтверждает суть данного предракового поражения ткани предстательной железы. Большинство опухолей диагностируют при первой повторной биопсии с высшей стадией, степенью и большим объемом, и такие пациенты, очевидно, выигрывают от вмешательства по сравнению с больными с консервативным ведением. В представленном обзоре проанализированы современные данные о связи между ПИН высокой степени и РПЖ. Установлено, что у пациентов с исходным диагнозом изолированной ПИН высокой степени следует считать повторную биопсию обязательной. Для решения проблемы оптимального ведения больных с локализованными формами данного заболевания и состояния качества жизни после хирургического вмешательством по поводу РПЖ необходимы большие проспективные исследования с более длительным периодом наблюдения.
клинически значимый рак предстательной железы, простатическая интраэпителиальная неоплазия высокой степени, повторные биопсии.














Leave a comment