Особливості виконання панкреатодуоденальної резекції в дітей
Щепотин И.Б., Лукашенко А.В., Колесник Е.А., Приймак В.В., Жуков Ю.А. , Бурлака А.А., Климнюк Г.И., Грабовой А.Н., Головко Т.С., Лаврик Г.В., Ганич О.В. , Халилеев А.А.
Резюме. Злоякісні новоутворення підшлункової залози — рідкісна пухлинна патологія у дитячому та юнацькому віці. Хірургічне лікування є пріоритетним для досягнення найкращих віддалених результатів. При локалізації пухлини в ділянці головки підшлункової залози тільки панкреатодуоденальна резекція (ПДР) дозволяє провести лікування в радикальному обсязі. У більшості випадків ПДР у дітей не виконують, навіть при морфологічному підтвердженні злоякісного новоутворення. Основною причиною є відсутність досвіду у виконанні таких втручань у дітей, а також високий відсоток ускладнень і летальності після ПДР у дорослих. У статті ми представляємо наш досвід виконання ПДР у дівчинки віком 5 років і хлопчика віком 1 рік та 10 міс. ПДР виконували з приводу солідної псевдопапілярної пухлини та тератоми відповідно, локалізованих в головці підшлункової залози. В обох випадках операції проведено в радикальному обсязі із формуванням панкреатоєюноанастомозу за методом «протока-із-слизовою» та авторською модифікацією реконструктивного етапу «повністю ізольованої реконструкції за Ру». У післяопераційний період не відмічали ускладнень, обидві дитини виписані в задовільному стані. При аналізі даних, представлених в зарубіжній літературі, слід зазначити, що досвід ПДР у дітей практично відсутній. Відповідно, відсутні шляхи оптимального виконання панкреатоєюноанастомозу та методу реконструкції. Так само як і діагностичні алгоритми, особливості анестезії, морфологічна класифікація пухлин підшлункової залози у дітей досі залишаються не визначеними. Зважаючи на відсутність даних про віддалені функціональні зміни після ПДР, запропонований метод ізольованої реконструкції є найбільш фізіологічно обґрунтованим. ПДР у дітей та підлітків слід виконувати тільки у високоспеціалізованих центрах, що мають широкий досвід проведення подібних втручань у дорослих.
Резюме. Злокачественные новообразования поджелудочной железы — редкая опухолевая патология в детском и подростковом возрасте. Хирургическое лечение является приоритетным для достижения наилучших отдаленных результатов. При локализации опухоли в головке поджелудочной железы только панкреатодуоденальная резекция (ПДР) позволяет провести лечение в радикальном объеме. В большинстве случаев ПДР у детей не выполняют даже при морфологическом подтверждении злокачественного новообразования. Основной причиной является отсутствие опыта выполнения подобных операций у детей, а также высокий процент осложнений и летальности после ПДР у взрослых. В данной статье мы представляем наш опыт выполнения ПДР у девочки 5 лет и мальчика 1 года и 10 мес. ПДР применялись по поводу солидной псевдопапиллярной опухоли и тератомы соответственно, локализованных в головке поджелудочной железы. В обоих случаях операции были проведены в радикальном объеме с формированием панкреатоеюноанастомоза по методу «проток-со-слизистой» и с авторской модификацией реконструктивного этапа «полностью изолированной реконструкции по Ру». В послеоперационном периоде не было отмечено осложнений, оба пациента выписаны в удовлетворительном состоянии. При анализе данных, представленных в зарубежной литературе, следует отметить, что опыт ПДР у детей практически отсутствует. Следовательно, отсутствуют рекомендации относительно оптимального панкреатоеюноанастомоза, метода реконструкции, также как и диагностические алгоритмы, особенности анестезии, морфологическая классификация опухолей поджелудочной железы у детей остаются не определенными. Ввиду отсутствия данных об отдаленных функциональных изменениях после ПДР у детей предложенный метод изолированной реконструкции представляется наиболее физиологически обоснованным. ПДР у детей и подростков должны выполняться только в высокоспециализированных центрах, располагающих большим опытом выполнения подобных операций у взрослых.

Опухоли поджелудочной железы в подростковом и детском возрасте встречаются редко и, по данным T.S. Ahmed и соавторов, их удельный вес составляет не более 1% от всех заболеваний поджелудочной железы, возникающих в возрасте <20 лет [1]. Согласно данным, основанным на результатах аутопсий, проведенных японскими авторами, новообразования поджелудочной железы у детей в возрасте до 14 лет составляют 0,2% в структуре смертности от злокачественных опухолей [2]. Основными морфологическими подтипами в раннем возрасте являются солидная псевдопапиллярная опухоль (СПО) и панкреатобластома [3, 4]. Среди более редких подтипов следует также отметить ацинарно-клеточную карциному, нейроэндокринные опухоли, саркомы и лимфомы [5]. СПО диагностируют чаще в подростковом возрасте, тогда как для панкреатобластомы медиана наивысшей заболеваемости составляет 4 года [6]. Средние показатели 5-летней выживаемости составляют 88% при СПО, 66% — при панкреатобластоме, 58% — при нейроэндокринных опухолях и 33% — при карциномах [4].
Учитывая редкость этой нозологической формы, большинство данных в международной литературе представлены в виде единичных клинических случаев. В настоящее время отсутствуют общепринятые диагностические алгоритмы, четкая радиологическая и морфологическая семиотика, а также консенсусы относительно наилучшей лечебной тактики у детей при новообразованиях поджелудочной железы [7]. Детский возраст, а также редкость заболеваний обусловливают неудовлетворительную раннюю диагностику. В ⅓ случаев опухоли поджелудочной железы у детей выявляют случайно на фоне отсутствия каких-либо клинических проявлений [7]. Отдаленные метастазы и вовлечение смежных органов при первичной диагностике отмечают в 19,5% при СПО и в >33% — при панкреатобластоме [8–14].
Для новообразований головки поджелудочной железы единственным радикальным лечением является панкреатодуоденальная резекция (ПДР). У взрослых ПДР относится к хирургическим вмешательствам повышенного риска. Несмотря на общую тенденцию к снижению летальности, риск послеоперационных осложнений составляет 30–50%, даже в высокоспециализированных центрах [15–25]. Осложнения, связанные с панкреатоанастомозом (ПА), такие как несостоятельность, абсцедирование, перитонит, сепсис и кровотечение, являются основной причиной смерти при ПДР [15, 16, 20, 23, 25–28]. Cпособы реконструкции при ПДР, также как и критерии несостоятельности ПА, на сегодня не унифицированы в международной литературе [29]. В большинстве случаев радикальное лечение при новообразованиях поджелудочной железы у детей не проводится. Основными факторами, сдерживающими хирургов от выполнения ПДР у детей, являются техническая сложность операции, риск непосредственных осложнений, возможные отставания в росте и развитии ребенка в послеоперационном периоде, а также поздние функциональные осложнения, связанные с развитием билиарного и гастрального рефлюксов, атрофии культи поджелудочной железы и т.д. [30]. В то время как данные отдаленных функциональных результатов при ПДР у взрослых представлены единичными исследованиями, подобная информация относительно детей практически отсутствует [30–38].
Технические аспекты операции, способ формирования ПА, выбор оптимального метода реконструкции — лишь некоторые из множества вопросов, касающихся особенностей ПДР у детей, которые будут рассмотрены в данной статье.
Клинические случаи
Пациент 1
В клинику Национального института рака поступила девочка в возрасте 5 лет с опухолью больших размеров, определяемой при пальпации в брюшной полости, выполняющей весь правый фланк. Месяцем ранее у пациентки была произведена эксплоративная лапаротомия с биопсией, установлен предварительный диагноз — злокачественная опухоль, локализованная в головке поджелудочной железы. На момент осмотра больная не предъявляла жалоб, также не выявлено клинических признаков нарушения экзокринной либо эндокринной функции поджелудочной железы. Лабораторные показатели функций печени, поджелудочной железы, а также опухолевые маркеры были в пределах нормы. Данные ультразвукового исследования и магнитно-резонансной томографии (МРТ) подтвердили наличие высокогетерогенной опухоли в головке поджелудочной железы размерами 8,5×7,5×5,5 см, деформирующей стенку верхней брыжеечной вены на уровне устья нижней панкреатодуоденальной вены (рис. 1, 2)

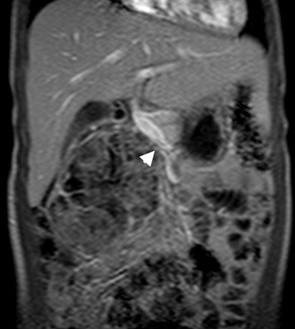
При МРТ проводили 3D-реконструкцию сосудистой системы, при которой отмечена вариантная анатомия артериального кровоснабжения печени, соответствующая типу 3 по классификации Michels (отхождение правой печеночной артерии от верхней брыжеечной артерии) [39].
Пациентка была подготовлена к выполнению хирургического вмешательства.
Техника оперативного вмешательства
После выполнения стандартной лапаротомии бисубкостальным доступом при ревизии в брюшной полости выявлена опухоль, практически полностью замещающая головку поджелудочной железы, смещающая влево верхние мезентериальные артерию и вену. У пациентки выполнена ПДР, которая включала дистальную резекцию желудка, удаление двенадцатиперстной кишки, холецистэктомию с удалением холедоха (от уровня впадения пузырного протока и далее в каудальном направлении), резекцию 5 см начального отдела тонкой кишки, резекцию головки и перешейка поджелудочной железы. Пересечение поджелудочной железы производили скальпелем, на линии среза со стороны поджелудочной железы был визуализирован общий панкреатический проток диаметром 1,2 мм. Гемостаз двух точечных участков артериального кровотечения на срезе культи поджелудочной железы выполнен биполярным электрокоагуляционным пинцетом. Далее проведено полное удаление крючковидного отростка поджелудочной железы. Данная процедура начата с небольшой тракции головки поджелудочной железы вправо и противотракции верхних мезентериальных сосудов влево, что позволило хорошо визуализировать связку крючковидного отростка и панкреатодуоденальные сосуды. При этом выделение связки крючковидного отростка осуществляли биполярным коагуляционным пинцетом (толщина бранши 2 мм), начиная с нижнего края правой полуокружности верхней брыжеечной вены и далее вверх по направлению к портальной вене. После перевязки нижней панкреатодуоденальной артерии была установлена опухолевая инвазия в устье нижней панкреатодуоденальной вены и произведена линейная en-block резекция верхней брыжеечной вены в этой зоне с ушиванием дефекта линейным атравматичным швом (монофиламентная нерассасывающаяся нить 5–0) (рис. 3, 4).
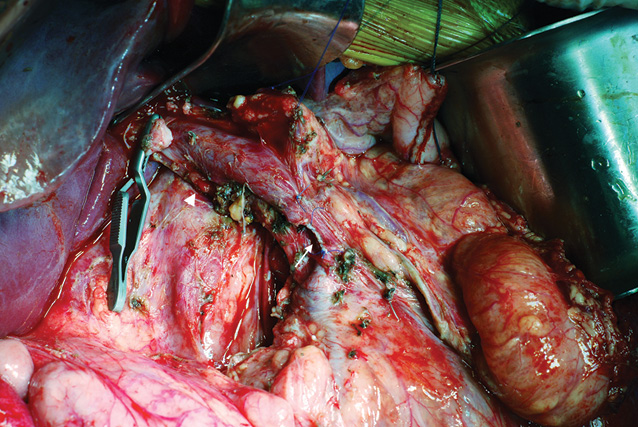

Крючковидный отросток сначала был полностью отделен от верхней брыжеечной и портальной вены, после чего начато выделение правой полуокружности верхней брыжеечной артерии. Последняя была взята на держалку, что позволило четко визуализировать и избежать травматизации вариантно расположенной правой печеночной артерии. В соответствии с данными МРТ 3D-реконструкции сосудистой системы, у пациентки правая печеночная артерия брала свое начало не от общей печеночной артерии, а от начального отдела верхней брыжеечной артерии и располагалась на 1 см дистальнее устья последней (см. рис. 3).
Данный анатомический вариант формирования правой печеночной артерии требует особой осторожности при выполнении ПДР, так как выделение крючковидного отростка может сопровождаться ее ранением с дальнейшим некрозом правой доли печени. После удаления гастропанкреатодуоденального комплекса культя поджелудочной железы была мобилизована по задней поверхности на 1 см в каудальном направлении путем рассечения соединительной ткани между телом поджелудочной железы и селезеночной веной; при этом капсула на передней поверхности железы была тщательно сохранена.
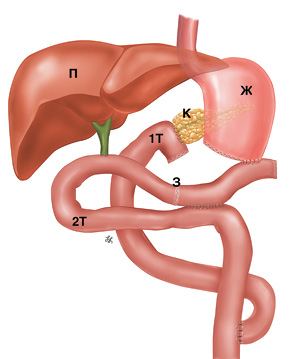
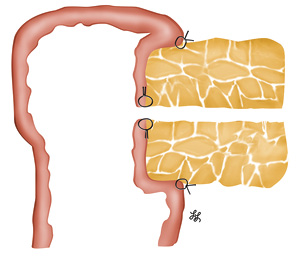
Далее мы приступили к кишечной реконструкции согласно авторской методике «полностью изолированной реконструкции по Ру» (рис. 5), подробно описанной в предыдущих публикациях у взрослых пациентов [40–42], а также в патентах [43, 44].
Особенностью выполнения реконструкции у ребенка оказались малые поперечные размеры культи поджелудочной железы — 10 мм, общего панкреатического протока — 1,2 мм и собственного печеночного протока — 4 мм. В данной ситуации формирование швов панкреатоеюноанастомоза следовало проводить с особой осторожностью во избежание ишемии культи поджелудочной железы и ранения общего панкреатического протока. Сформирован 2-рядный панкреатоеюноанастомоз «конец-в-бок» по принципу «проток-со-слизистой» [45]. Формирование анастомоза проводили с использованием бинокулярного увеличения в 2,5 раза. Сначала был наложен задний ряд швов между серомускулярным слоем стенки кишки и соединительной тканью, расположенной между задней поверхностью поджелудочной железы и селезеночной веной. При формировании данного ряда тщательно избегали прошивания ткани поджелудочной железы (рис. 6).
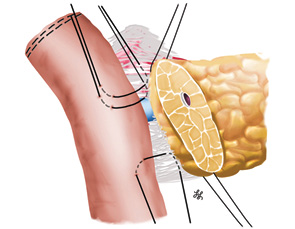
Отверстие в тонкой кишке размером, соответствующим диаметру панкреатического протока, выполнено по антимезентериальному краю с помощью электрокоагулятора (рис. 7).
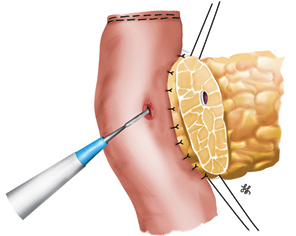
Далее главный панкреатический проток диаметром 1,2 мм прошили 7 отдельными швами (монофиламентная нерассасывающаяся нить 6–0 с двумя атравматичными иглами), при этом в шов вовлекали только стенку протока (рис. 8).
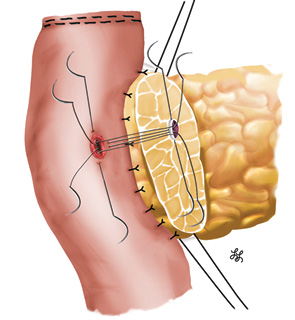
Учитывая малый диаметр протока, сначала наложили 4 шва с интервалом в ¼ окружности протока, что позволило несколько растянуть последний, после чего дополнительно — еще 3 шва между предыдущими. Подобная методика у взрослых позволяет накладывать 15 и более швов. Для предупреждения смешивания нитей использовали наружные держалки. Далее 4 шва на задней стенке протока были прошиты через все слои стенки кишки и завязаны (рис. 9).
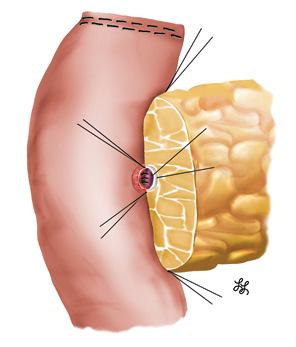
Переднюю стенку внутреннего шва по методу «проток-со-слизистой» завершили прошиванием передней стенки кишки согласно уже нашитым 3 нитям на передней стенке протока (рис. 10).
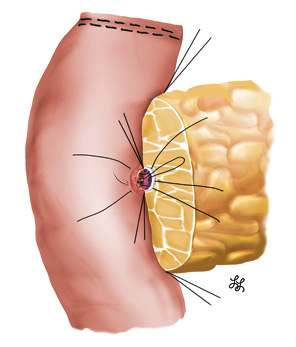
Панкреатоеюноанастомоз закончили формированием наружного шва брюшины, покрывающей переднюю поверхность поджелудочной железы, с серомускулярным слоем кишки (монофиламентная нерассасывающаяся нить 5–0). При этом боковые швы по верхнему и нижнему краям были сформированы путем прошивания не только капсулы поджелудочной железы, но и ранее завязанных в качестве боковых держалок 2 краевых поперечных швов (патент № 67346) [44], что позволило избежать прорезывания нитей через мягкую ткань железы (рис. 11, 12). При создании панкреатоеюноанастомоза мы не применяли ни наружного, ни внутреннего стентирования панкреатического протока.
Гастроеюноанастомоз сформирован на 2-й тонкокишечной петле впередиободочно путем наложения наружного и внутреннего ряда узловых швов (монофиламентная рассасывающаяся нить № 4–0). Также создана микрогастростомия по Витцелю (монофиламентная рассасывающаяся нить № 4–0) как альтернатива назогастральной интубации. Следующим этапом реконструкции было формирование однорядного гепатикоеюноанастомоза по методике «конец-в-бок» на 20 см дистальнее гастроеюноанастомоза. Гепатикоеюноанастомоз был сформирован узловыми швами (монофиламентная нерассасывающаяся нить № 6–0) также без применения стентов. На 10 см дистальнее гепатикоеюноанастомоза образовано межкишечное соустье с заглушкой приводящей петли для предупреждения рефлюкса пищи в желчные протоки. Реконструктивный этап завершен формированием межкишечного анастомоза по Ру. Таким образом, петля кишки, отводящая от панкреатоеюноанастомоза, была включена в пассаж. Дренирование брюшной полости произведено одним дренажем из правого подреберья к переднему краю панкреатоеюноанастомоза. Операционная рана ушита стандартным способом.
Послеоперационный период
В послеоперационный период проводили мониторинг всех основных лабораторных и функциональных показателей пациентки. Терапия ингибиторами протонной помпы, а также блокаторами гистаминовых Н2-рецепторов продолжалась 5 послеоперационных дней. Аналог соматостатина назначен в подкожном введении 50 мг 2 раза в течение 3 дней. Дренаж удален на 5-е сутки при подтверждении состоятельности панкреатоеюноанастомоза (начиная с 3-х послеоперационных суток уровень амилазы в послеоперационном дренаже не должен превышать таковой в крови более чем в 3 раза) по критериям Международной группы по изучению панкреатической фистулы (International Study Group on Pancreatic Fistula — ISGPF) [46]. Микрогастростома удалена на 5-е сутки на фоне отсутствия задержки эвакуации пищи из культи желудка. Пероральный прием жидкости был начат на 1-е сутки после операции, прием адаптированных энтеральных смесей — со 2-х суток после операции. Пациентка выписана на 15-е послеоперационные сутки и чувствует себя удовлетворительно через 2 мес после операции.
При морфологическом исследовании установлено наличие в головке поджелудочной железы СПО, что также подтверждено иммуногистохимическим исследованием. Доказаны чистота краев резекции поджелудочной железы, двенадцатиперстной кишки и общего желчного протока и отсутствие опухолевых клеток в регионарных лимфатических узлах.
Пациент 2
Мальчик в возрасте 1 года и 10 мес был доставлен в клинику Национального института рака с опухолью в эпигастральной области, деформирующей переднюю брюшную стенку. Со слов родителей пациента, деформация брюшной стенки была замечена случайно около 2 мес назад без предварительного анамнеза. Данные клинических методов обследования, а также лабораторные исследования не выявили каких-либо патологических изменений, за исключением пальпируемой, смещаемой опухоли, занимающей правый фланк брюшной полости. Ультразвуковое исследование брюшной полости показало хорошо дифференцируемую гетерогенную массу, визуализируемую в виде чередующихся высоко- и слабоэхогенных зон с признаками обедненного кровотока, занимающую перешеек и головку поджелудочной железы, значительно смещающую портальную и верхнюю мезентериальную вену. При МРТ подтверждено наличие округлого образования размером 6×7×6 см в головке поджелудочной железы с хорошо дифференцируемой капсулой, смещающего портальную вену влево и вверх (рис. 13).

Как и в предыдущем клиническом случае, при МРТ 3D-реконструкции сосудистой системы установлен аналогичный вариант сосудистой анатомии правой печеночной артерии, тип 3 по классификации Michels (рис. 14).
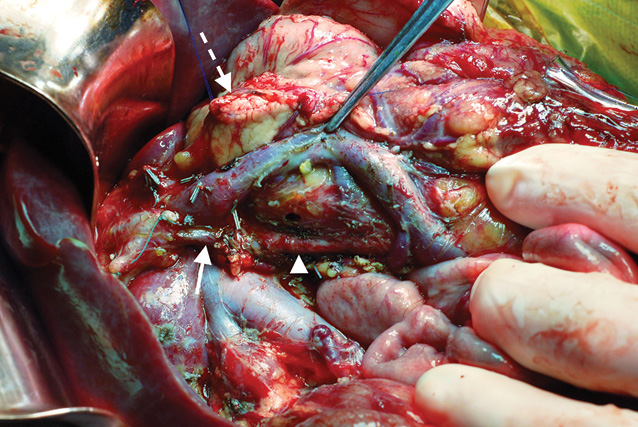
Ребенку произведена ПДР в стандартном объеме. Реконструктивный этап выполняли аналогично первому описанному случаю. Из особенностей следует отметить распространение опухоли на брыжейку тонкой кишки, что вызвало необходимость расширить диссекцию до выделения тонкокишечных сосудов 1-го порядка. В данном представленном случае диаметр общего панкреатического протока оказался еще меньшим (0,7 мм), что позволило наложить только 4 шва на внутренний ряд при формировании панкреатоэнтероанастомоза. В послеоперационный период применен аналогичный алгоритм ведения пациента. Дренаж был удален на 4-е сутки. Микрогастростому удалили на 10-й день, что было связано с наличием признаков гастростаза до 9-х суток после операции. Пациент выписан из стационара на 16-е сутки и в настоящее время, через полтора месяца после операции, чувствует себя удовлетворительно.
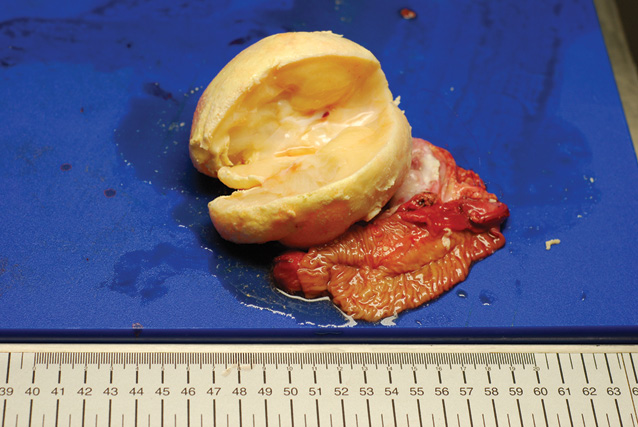
Путем морфологического исследования опухоль классифицирована как высокодифференцированная тератома, исходящая из головки поджелудочной железы. Подтверждены чистота краев резекции и отсутствие метастазов в регионарных лимфатических узлах (рис. 15). Масса удаленной опухоли составила 310 г, что равнялось 2,6% от общей массы тела ребенка (12 кг).
Обзор литературы
При анализе данных литературы за период с 1952 по 2013 гг. обнаружено 43 публикации, в которых описано выполнение ПДР по поводу злокачественных новообразований у 98 пациентов в возрасте до 19 лет, из них только в 14 сообщениях освещено выполнение ПДР у 20 детей в возрасте 5 лет и младше. Данные пациентов (пол, возраст, морфология опухоли и т.д.) представлены в табл. 1. В этом обзоре количество наблюдений у мальчиков было большим, соотношение с таковым у девочек составило 4:1.
Таблица 1. Характеристика пациентов
| Автор/год публикации | Страна | № | Пол | Возраст (годы) | Морфология опухоли | Вид операции |
| R.E. Gross (1952) [47] | США | 1 | м | 2 | лимфома | ПДР |
| W.F. Becker (1957) [47] | США | 2 | м | 1 | НЭО | ПДР |
| R.M. Jaube (1964) [82] | Франция | 3 | м | 4 | НЭО | ПДР |
| E.W. Fonkalsrud (1966) [77] | США | 4 | м | 2 | СПО | ПДР |
| R.H. Rich (1986) [48] | Канада | 5 | м | 3 нед | панкреатобластома | ПСПДР |
| R.C. Shamberger (1994) [71] | США | 6 | НД | 2,5 | НД | ПДР |
| S. Vossen (1998) [81] | Германия | 7 | ж | 3 | панкреатобластома | ПДР |
| A.A. Défachelles (2001) [80] | Франция | 8 | м | 2 | панкреатобластома | ПСПДР |
| N.A. Shorter (2002) [62] | США | 9 | м | 3 | панкреатобластома | ПДР |
| 10 | м | 5 | НЭО | ПСПДР | ||
| T. Yonekura (2006) [14] | Япония | 11 | м | 3 | панкреатобластома | ПДР + резекция портальной вены + правосторонняя гемиколэктомия |
| L. Cao (2007) [79] | КНР | 12 | ж | 4 | панкреатобластома | ПДР |
| W.Z. Gu (2008) [78] | КНР | 13 | ж | 4 | панкреатобластома | ПСПДР |
| D.C. Yu (2009) [12] | США | 14 | м | 5 | АКК | ПДР |
| C.O. Muller (2012) [61] | Франция | 15 | м | 0,7 | нейробластома | ПСПДР |
| 16 | ж | 1 | нейробластома | ПСПДР | ||
| 17 | м | 2 | рабдомиосаркома | ПДР | ||
| 18 | м | 2 | АРА | ПДР | ||
| 19 | м | 2 | ПП | ПСПДР | ||
| 20 | ж | 5 | рабдомиосаркома | ПДР |
НЭО — нейроэндокринная опухоль; АКК — ацинарно-клеточная карцинома; АРА — атипическая ренальная ангиомиолипома; ПП — псевдокиста поджелудочной железы; НД — нет данных; ПСПДР — пилоросохраняющая ПДР.
Впервые Robert E. Gross выполнил успешную ПДР по поводу лимфомы головки поджелудочной железы у 2-летней девочки в 1952 г. Информация об этой операции была опубликована в 1957 г. [47]. Самым младшим в нашем обзоре оказался новорожденный ребенок в 3-недельном возрасте. Данный случай был описан R.H. Rich и соавторами в 1986 г. Мальчика успешно прооперировали в Клинике для больных детей (The Hospital for Sick Children) в Торонто, Канада [48]. Основным гистологическим типом опухолей, по поводу которых выполняли ПДР детям раннего возраста, являлись панкреатобластомы (35%).
Представленные сообщения, а также данные о лечении детей старшего возраста свидетельствуют о том, что в большинстве случаев хирурги стараются избежать выполнения ПДР, даже при наличии морфологического подтверждения злокачественного новообразования головки поджелудочной железы [10]. Данная ситуация обусловлена как отсутствием опыта подобных операций у детей, так и тем фактом, что ПДР является хирургическим вмешательством повышенного риска у взрослых [49]. У детей малый поперечный диаметр поджелудочной железы и общего панкреатического протока значительно усложняет выполнение ПА [50]. В то же время «органосберегающая» тактика, вылущивание либо энуклеация опухоли у детей неприемлемы, так как являются причиной ранних рецидивов [51, 52], а также ассоциированы с более высоким уровнем послеоперационных осложнений со стороны поджелудочной железы [7].
Определение наилучшего способа формирования панкреатоеюноанастомоза у взрослых в настоящее время остается предметом дискуссий [29]. У детей описание способа реконструкции после ПДР в большинстве сообщений отсутствует. Ряд японских авторов описывают создание панкератогастроанастомоза [14, 49, 50]. Однако, согласно данным K. Sugito и соавторов, при подобной технике была отмечена атрофия культи поджелудочной железы, а также расширение и деформация главного панкреатического протока, сохраняющиеся в течение 3 лет после операции [50]. В нашем случае использование современного интраоперационного бинокулярного увеличения позволило сформировать панкреатоеюноанастомоз согласно методике «проток-со-слизистой», даже при очень маленьком панкреатическом протоке. Мы успешно наложили 7 внутренних швов при диаметре протока 1,2 мм у 5-летней девочки и 4 шва при протоке 0,8 мм у мальчика в возрасте 1 года 10 мес.
На сегодня описано более 200 методов реконструкции после ПДР у взрослых, что свидетельствует об отсутствии оптимального способа, который позволил бы избежать несосотоятельности ПА. Патофизиологические механизмы возникновения несостоятельности панкреатоеюноанастомоза до конца не известны. Одна из теорий основана на том факте, что классическая последовательная реконструкция на одной кишечной петле может приводить к перекрестным рефлюксам желчи, панкреатического сока и содержимого желудка [53]. Результаты некоторых экспериментальных работ продемонстрировали основную роль рефлюкса желчи в интрацеллюлярной активации ферментов поджелудочной железы, что может вести к панкреатиту культи поджелудочной железы в ранний послеоперационный период, а также к тотальному фиброзу железы в отдаленные сроки [54, 55]. Желчь разрушает защитные механизмы, предотвращающие внутриклеточную активацию трипсиногена в трипсин [55]. Одним из патологических путей является смена поляризации клеток поджелудочной железы с базальной на апикальную под воздействием желчных кислот [56]. Классическая последовательная реконструкция на одной кишечной петле сопровождается также рефлюксами панкреатического сока и желчи в культю желудка, что приводит к развитию анастомозита гастроэнетроанастомоза, рефлюкс-эзофагита, а также к возникновению пищевода Барретта с возможной трансформацией в рак пищевода в будущем [57, 58].
Исходя из вышеописанных патологических изменений, представленный метод «изолированной реконструкции по Ру» можно называть имеющим физиологическую основу. Наша методика успешно применена у более чем 80 взрослых пациентов [41] и в настоящее время хорошо себя зарекомендовала у детей. Реконструкция по Ру наиболее близка к нормальной физиологии человека, так как предотвращает возможные перекрестные рефлюксы желчи и панкреатического сока в желудок и наоборот — в общий панкреатический либо желчный протоки.
При анализе данных литературы, включавших 5 и более детей в возрасте от 3 мес до 18 лет, установлено, что количество ранних послеоперационных осложнений составляет от 14,3 до 45,5%, при этом показатели несостоятельности ПА находятся в пределах 9–20% (табл. 2).
Таблица 2. Ранние послеоперационные осложнения
| Автор/год публикации | Возраст (годы) | Осложнения (%) | Спектр осложнений | Повторная операция | Послеоперационное наблюдение (годы) |
|---|---|---|---|---|---|
| W.F. Becker (1957) [47] | 1 | НД | Несостоятельность гепатикоеюноанастомоза | Нет | 3 |
| S.E. Jung (1999) [70] | 11 | 20 | Спаечная кишечная непроходимость | Рассечение спаек | 2 |
| N.A. Shorter, (2002) [62] | 13 | 14 | Тромбоз селезеночной вены, варикоз вен пищевода | Нет | 6 |
| R. Dasgupta, (2005) [49] | 9 | 40 | Панкреатическая фистула, задержка эвакуации из культи желудка, инфицирование раны | Нет | >1 |
| D.C. Yu (2009) [12] | 9 | 40 | Поддиафрагмальный абсцесс | Нет | 3 |
| 5 | Панкератическая фистула, интраабдоминальный абсцесс, аортокишечная фистула | Дренирование абсцесса | Умер через 2 мес после операции от кровотечения | ||
| T.W. Reichman (2011) [60] | НД | НД | Томбоз портальной вены, варикоз вен пищевода, повторяющиеся кишечные кровотечения | Портопортальный шунт | 2 |
| G. Marchegiani (2011) [7] | 16 | 29 | Лимфорея | Нет | 2 |
| 17 | Панкреатическая фистула | Нет | 15 | ||
| C.O. Muller (2012) [61] | 12 | 46 | Транзиторный экссудативный плеврит | Нет | >2 |
| 11 | Задержка эвакуации из культи желудка | Нет | >2 | ||
| 2 | Инвагинационная кишечная непроходимость |
Нет | >2 | ||
| 5 | Панкреатическая фистула, несостоятельность гепатикоеюноанастомоза, кишечный свищ | Нет | >2 | ||
| 2 | Тромбоз портальной вены | Чрескожная тромбэктомия, эндоваскулярное стентирование портальной вены | >2 | ||
| A.C. Faircloth (2012) [59] | 17 | НД | Интраоперационное кровотечение во время реконструкции портальной вены, полиорганная недостаточность | Нет | Умерла на 6-е сутки после операции |
НД — нет данных.
Прочие осложнения включают также несостоятельность билиодигестивного анастомоза, задержку эвакуации из культи желудка, кишечную непроходимость и др. Только в 3 случаях осложнения возникли у детей в возрасте 5 лет и младше; ⅔ осложнений описаны у детей старше 8 лет, физиология которых более близка к таковой взрослых. Основными причинами релапаротомий в данной группе были интраабдоминальные абсцессы, а также послеоперационная спаечная кишечная непроходимость. При анализе осложнений, возникающих у детей после ПДР, следует отметить 3 сообщения о сосудистых осложнениях, связанных с портальной венозной системой. В одном из описанных случаев резекция портальной вены привела к смерти пациентки 17 лет в ранний послеоперационный период [59]. В 2 других случаях авторы сообщают о возникновении тромбоза портальной вены при стандартной ПДР без сосудистой резекции [60, 61]. Одному из пациентов произведена чрескожная тромбэктомия с последующей 2-кратной баллонной дилатацией и установкой внутрисосудистого стента [61]. В другом случае ранение портальной вены во время ПДР вызвало необходимость ушивания венозной стенки, что привело к окклюзии сосуда и развитию портальной гипертензии. В дальнейшем у ребенка периодически возникали кровотечения из расширенных вен пищевода, что потребовало хирургического вмешательства с формированием декомпрессионного шунта между верхней мезентериальной и левой портальной веной по методу Rex [60].
По данным литературы, даже при отсутствии резекции сосудов, дети более подвержены риску тромбоза портальной и верхней брыжеечной вены, чем взрослые, при ПДР [61, 62]. Данный факт подтверждает необходимость детальной дооперационной диагностики с 3D-реконструкцией как портальной системы, так и артериальных вариантов кровоснабжения печени. Качественная КТ/МРТ сосудистая реконструкция позволяет оптимизировать тактику при необходимости портальной резекции, а также предотвратить ряд потенциально летальных осложнений, связанных с риском ранения вариантно расположенных артериальных сосудов. В обоих представленных нами случаях на дооперационном этапе была диагностирована вариантная анатомия правой печеночной артерии, когда последняя берет свое начало от верхней брыжеечной артерии. Данный тип развития правой печеночной артерии отмечают с частотой 13–14%, что свидетельствует о возможной связи редких анатомических сосудистых вариантов с риском возникновения новообразований.
Мы обнаружили 2 сообщения о летальном исходе при ПДР у детей. Интраоперационная кровопотеря с последующей полиорганной недостаточностью были причиной смерти одного из пациентов, в другом случае 5-летний пациент умер от кровотечения из дефекта аорты, возникшего через 2 мес после ПДР на фоне несостоятельности панкреатоеюноанастомоза. C.O. Muller и соавторы в одном из наибольших обзоров собственного опыта проведения ПДР у детей (11 операций) при сравнении со взрослыми пациентами отмечают несколько более низкую летальность у детей (1%) на фоне такого же общего показателя послеоперационных осложнений (45%) [61].
Немаловажным является вопрос об отдаленных физиологических изменениях после ПДР у детей. Удаление части поджелудочной железы связано с риском развития эндокринной и экзокринной недостаточности, что в комплексе с нефизиологическим пассажем желчи, желудочного содержимого может приводить к задержке роста, отставанию в развитии ребенка, а также к различным патологическим изменениям в желудке, печени и культе поджелудочной железы [50, 63].
Согласно сообщению E. Lemaire и соавторов, у детей повышен риск развития жировой мальабсорбции в течение первого года после ПДР. Причина послеоперационной мальабсорбции многофакторна. В ее основе лежат инактивация панкреатических ферментов как результат низкой pH желудка, стеноз панкреатогастроанастомоза с последующим развитием атрофии культи поджелудочной железы, а также нарушение нейрогуморальной регуляции [64].
Начиная с 1952 г. мы обнаружили 10 сообщений о длительном наблюдении физиологических изменений у детей после ПДР. В данных публикациях описаны случаи заболевания 21 пациента в возрасте от 3 нед до 18 лет с медианой наблюдения 4,5 года (0,8–16 лет) (табл. 3). Нарушения роста были зафиксированы у 3 (14,3%) больных: у 1 пациента после пилоросохраняющей ПДР и у 2 — после классической ПДР с резекцией антрального отдела желудка. При этом у 78% пациентов, которым производили удаление антрального отдела желудка, в последующем не отмечали каких-либо нарушений в росте и развитии. Согласно полученным данным, сохранение привратника у детей при ПДР скорее всего не влияет в последующем на нутритивный статус пациентов, однако данный вопрос требует большего количества наблюдений [63].
Таблица 3. Поздние функциональные осложнения
| Автор/год | n | Возраст (годы) | Наблюдение (годы) | Экзокринная недостаточность (n) | Эндокринная недостаточность (n) | Отставание в росте (n) | Сохранение привратника (n) |
| W.F. Becker (1957) [47] | 1 | 1 | 3 | 1 | 0 | 1 | 0 |
| E.W. Fonkalsrud (1966) [77] | 1 | 2 | 5 | 1 | 0 | 0 | 0 |
| J.L. Grosfeld (1970) [76] | 1 | 12 | 1 | НД | НД | 0 | 0 |
| P.T. Mah (1974) [75] | 1 | 9 | 10 мес | 1 | 0 | 1 | 0 |
| J.B. Taxy (1976) [74] | 1 | 13 | 3 мес | 0 | 0 | НД | 0 |
| S.L. Kaufman (1986) [73] | 1 | 11 | 5 | 1 | 0 | 0 | 1 |
| R.H. Rich (1986) [48] | 1 | 3 нед | 4 | 1* | 0 | 1 | 1 |
| K. Newman (1992) [72] | 1 | 15 | 4 | 0 | 0 | 0 | 1 |
| R.C. Shamberger (1994) [71] | 5 | 2,5–10 | НД | 3 | НД | НД | НД |
| S.E. Jung (1999) [70] | 5 | 9–13 | 1,5–13,5 | 0 | НД | НД | 3 |
| R. Dasgupta (2005) [49] | 5 | 9–17 | 1–7,5 | 1 | НД | НД | 5 |
| A. Marwan (2009) [69] | 1 | 10 | 3 нед | 0 | НД | НД | НД |
| E. Yaacobi (2010) [68] | 1 | 10 | 2 | НД | НД | 0 | 1 |
| R. Ohata (2010) [67] | 1 | 9 | 1,5 | 0 | НД | НД | 0 |
| G. Marchegiani (2011) [7] | 7 | 7–18 | 1–16 | 3 | 1 | НД | 5 |
| K. Sugito (2012) [50] | 2 | 10 | 15, 5 | 2** | 2*** | 0 | 2 |
| C.O. Muller (2012) [61] | 11 | 8 мес – 13 | 2–11 | 0 | 0 | 0 | 7 |
| A.L. Speer (2012) [51] | 4 | 9–17 | 0,6–5,9 | НД | 0 | НД | 1 |
| Общие данные | 50 | 3 нед – 18 | 3 нед – 16 | 38% | 10%*** | 14% | 60% |
*нормализация через 1 мес; **низкая интенсивность, нормализация после 3 лет; ***низкая интенсивность, не требующая лечения; НД — нет данных.
K. Sugito и соавторы в 2012 г. окончили наиболее подробное на сегодня исследование функциональных и лабораторных данных у детей после ПДР [50]. Авторы выполнили целый ряд прямых и непрямых функциональных тестов, включавших кишечное зондирование со сбором панкреатического сока на фоне стимуляторов секреции, изучение стула пациентов на наличие жирных кислот и энзимов, оценку изменений в протеиновом составе плазмы крови (альбумин, трансферрин, преальбумин, ретинол-связанный протеин), изменений в соотношении иммуноглобулинов и т.д. Отмечено единственное достоверное увеличение HbA1c гликозилированного гемоглобина A1ct в плазме крови, однако не приводящее к развитию послеоперационного сахарного диабета [50]. Подобные исследования носят единичный характер, и данных относительно физиологических последствий ПДР у детей по-прежнему мало. Неясным остается риск патологических изменений в желчных протоках и паренхиме печени ребенка, связанных с холецистэктомией, резекцией холедоха и формированием гепатикоеюноанастомоза. Хронический холангит является фактором развития холангиокарциномы у взрослых, данные относительно подобных изменений у детей отсутствуют [65]. При анализе литературы мы обнаружили одно сообщение о развитии холангита, требующего периодического стационарного лечения, у новорожденного, перенесшего ПДР [48]. Авторы отмечают исчезновение эпизодов острого холангита через 2 года после операции.
Мы вынуждены констатировать факт отсутствия широкого мирового опыта проведения ПДР у детей. Учитывая хорошо известные данные американских авторов о достоверном уменьшении количества осложнений ПДР в высокоспециализированных центрах [66], целесообразным является концентрация подобных пациентов в клиниках, имеющих большой ежегодный опыт выполнения ПДР у взрослых. Успех в лечении опухолей поджелудочной железы у детей в значительной степени зависит от мультидисциплинарного подхода, включающего не только качественную хирургическую технику, но и точную дооперационную лучевую диагностику, а также адаптированное анестезиологическое сопровождение и современные методы послеоперационной реабилитации, что дает возможность снизить послеоперационную летальность и уменьшить количество осложнений [59].
Выводы
Радикальное хирургическое вмешательство в объеме ПДР является ключевым методом лечения новообразований головки поджелудочной железы у детей, приводящим к наилучшим отдаленным результатам.
Литературные данные относительно ПДР у детей представлены очень малым количеством случаев, все особенности выполнения данной операции (дооперационная диагностика, хирургическая техника, анестезиологическое пособие, реабилитация и др.) до настоящего момента неизвестны.
Мы рекомендуем авторский метод изолированной реконструкции по Ру как наиболее приближенный к нормальной физиологии.
ПДР у детей должна выполняться в высокоспециализированных центрах опытными гепатопанкреатобилиарными хирургами с использованием всех самых современных хирургических технологий (электрохирургический инструментарий, интраоперационный микроскоп, бинокулярное увеличение и др.)
Список использованной литературы
- Ahmed T.S., Chavhan G.B., Navarro O.M. et al. (2013) Imaging features of pancreatic tumors in children: 13-year experience at a pediatric tertiary hospital. Pediatric radiology, 43(11): 1435–1443.
- Tsukimoto I., Watanabe K., Lin J.B. et al. (1973) Pancreatic carcinoma in children in Japan. Cancer, 31(5): 1203–1207.
- Dall’igna P., Cecchetto G., Bisogno G. et al. (2010) Pancreatic tumors in children and adolescents: the Italian TREP project experience. Pediatric Blood & Cancer, 54(5): 675–680.
- Brecht I.B., Schneider D.T., Kloppel G. et al. (2011) Malignant pancreatic tumors in children and young adults: evaluation of 228 patients identified through the Surveillance, Epidemiology, and End Result (SEER) database. Klinische Padiatrie, 223(6): 341–345.
- Perez E.A., Gutierrez J.C., Koniaris L.G. et al. (2009) Malignant pancreatic tumors: incidence and outcome in 58 pediatric patients. J. Pediatr. Surgery, 44(1): 197–203.
- Bien E., Godzinski J., Dall’igna P. et al. (2011) Pancreatoblastoma: a report from the European cooperative study group for paediatric rare tumours (EXPeRT). Eur. J. Cancer, 47(15): 2347–2352.
- Marchegiani G., Crippa S., Malleo G. et al. (2011) Surgical treatment of pancreatic tumors in childhood and adolescence: uncommon neoplasms with favorable outcome. Pancreatology: official journal of the International Association of Pancreatology, 11(4): 383–389.
- Papavramidis T., Papavramidis S. (2005) Solid pseudopapillary tumors of the pancreas: review of 718 patients reported in English literature. J. Am. Coll. Surg., 200(6): 965–972.
- Lee S.E., Jang J.Y., Hwang D.W. et al. (2008) Clinical features and outcome of solid pseudopapillary neoplasm: differences between adults and children. Arch Surg, 143(12): 1218–1221.
- Choi S.H., Kim S.M., Oh J.T. et al. (2006) Solid pseudopapillary tumor of the pancreas: a multicenter study of 23 pediatric cases. J. Pediatr. Surg., 41(12): 1992–1995.
- Zampieri N., Schiavo N., Capelli P. et al. (2011) Pseudopapillary tumor in pediatric age: clinical and surgical management. Pediatr. Surg. Int., 27(12): 1271–1275.
- Yu D.C., Kozakewich H.P., Perez-Atayde A.R. et al. (2009) Childhood pancreatic tumors: a single institution experience. J. Pediatr. Surg., 44(12): 2267–2272.
- Horisawa M., Niinomi N., Sato T. et al. (1995) Frantz’s tumor (solid and cystic tumor of the pancreas) with liver metastasis: successful treatment and long-term follow-up. J. Pediatr. Surg., 30(5): 724–726.
- Yonekura T., Kosumi T., Hokim M. et al. (2006) Aggressive surgical and chemotherapeutic treatment of advanced pancreatoblastoma associated with tumor thrombus in portal vein. J. Pediatr. Surg., 41(3): 596–598.
- Bottger T.C., Junginger T. (1999) Factors influencing morbidity and mortality after pancreaticoduodenectomy: critical analysis of 221 resections. World J. Surg., 23(2): 164–171; discussion 171–162.
- Buchler M.W., Friess H., Wagner M. et al. (2000) Pancreatic fistula after pancreatic head resection. Br. J. Surg., 87(7): 883–889.
- Cameron J.L., Pitt H.A., Yeo C.J. et al. (1993) One hundred and forty-five consecutive pancreaticoduodenectomies without mortality. Ann. Surg., 217(5): 430–435; discussion 435–438.
- Neoptolemos J.P., Russell R.C., Bramhall S. et al. (1997) Low mortality following resection for pancreatic and periampullary tumours in 1026 patients: UK survey of specialist pancreatic units. UK Pancreatic Cancer Group. Br. J. Surg., 84(10): 1370–1376.
- Trede M., Schwall G., Saeger H.D. (1990) Survival after pancreatoduodenectomy. 118 consecutive resections without an operative mortality. Ann. Surg., 211(4): 447–458.
- Yeo C.J., Cameron J.L., Sohn T.A. et al. (1997) Six hundred fifty consecutive pancreaticoduodenectomies in the 1990s: pathology, complications, and outcomes. Ann. Surg., 226(3): 248–257; discussion 257–260.
- Talamini M.A., Moesinger R.C., Pitt H.A. et al. (1997) Adenocarcinoma of the ampulla of Vater. A 28-year experience. Ann. Surg., 225(5): 590–599; discussion 599–600.
- Miedema B.W., Sarr M.G., van Heerden J.A. et al. (1992) Complications following pancreaticoduodenectomy. Current management. Arch. Surg., 127(8): 945–949; discussion 949–950.
- Geer R.J., Brennan M.F. (1993) Prognostic indicators for survival after resection of pancreatic adenocarcinoma. Am. J. Surg., 165(1): 68–72; discussion 72–63.
- Gouma D.J., van Geenen R.C., van Gulik T.M. et al. (2000) Rates of complications and death after pancreaticoduodenectomy: risk factors and the impact of hospital volume. Ann. Surg., 232(6): 786–795.
- Sohn T.A., Yeo C.J., Cameron J.L. et al. (2000) Resected adenocarcinoma of the pancreas-616 patients: results, outcomes, and prognostic indicators. J. Gastrointest. Surg., 4(6): 567–579.
- Berberat P.O., Friess H., Kleeff J. et al. (1999) Prevention and treatment of complications in pancreatic cancer surgery. Digestive Surg., 16(4): 327–336.
- Bakkevold K.E., Kambestad B. (1993) Morbidity and mortality after radical and palliative pancreatic cancer surgery. Risk factors influencing the short-term results. Ann. Surg., 217(4): 356–368.
- Shrikhande S.V., Qureshi S.S., Rajneesh N. et al. (2005) Pancreatic anastomoses after pancreaticoduodenectomy: do we need further studies? World J. Surg., 29(12): 1642–1649.
- Kleespies A., Albertsmeier M., Obeidat F. et al. (2008) The challenge of pancreatic anastomosis. Langenbeck’s archives of surgery. Deutsche Gesellschaft fur Chirurgie, 393(4): 459–471.
- Fish J.C., Smith L.B., Williams R.D. (1969) Digestive function after radical pancreaticoduodenectomy. Am. J. Surg., 117(1): 40–45.
- Jang J.Y., Kim S.W., Park S.J. et al. (2002) Comparison of the functional outcome after pylorus-preserving pancreatoduodenectomy: pancreatogastrostomy and pancreatojejunostomy. World J. Surg., 26(3): 366–371.
- Ishikawa O., Ohigashi H., Eguchi H. et al. (2004) Long-term follow-up of glucose tolerance function after pancreaticoduodenectomy: comparison between pancreaticogastrostomy and pancreaticojejunostomy. Surgery, 136(3): 617–623.
- Rault A., SaCunha A., Klopfenstein D. et al. (2005) Pancreaticojejunal anastomosis is preferable to pancreaticogastrostomy after pancreaticoduodenectomy for longterm outcomes of pancreatic exocrine function. J. Am. Coll. Surg., 201(2): 239–244.
- Nakamura H., Murakami Y., Uemura K. et al. (2009) Predictive factors for exocrine pancreatic insufficiency after pancreatoduodenectomy with pancreaticogastrostomy. Journal of gastrointestinal surgery: official journal of the Society for Surgery of the Alimentary Tract, 13(7): 1321-1327.
- Sato N., Yamaguchi K., Yokohata K. et al. (1998) Long-term morphological changes of remnant pancreas and biliary tree after pancreatoduodenectomy on CT. International surgery, 83(2): 136–140.
- Sho M., Nakajima Y., Kanehiro H. et al. (1998) A new evaluation of pancreatic function after pancreatoduodenectomy using secretin magnetic resonance cholangiopancreatography. Am. J. Surg., 176(3): 279–282.
- Pessaux P., Aube C., Lebigot J. et al. (2002) Permeability and functionality of pancreaticogastrostomy after pancreaticoduodenectomy with dynamic magnetic resonance pancreatography after secretin stimulation. J. Am. Coll. Surg., 194(4): 454–462.
- Aube C., Lebigot J., Pessaux P. et al. (2003) Evaluation of the permeability of pancreaticogastric anastomoses (PGA) with dynamic magnetic resonance pancreatography after secretin stimulation (secretin MRCP). Abdom. Imag., 28(4): 563–570.
- Michels N.A. (1966) Newer anatomy of the liver and its variant blood supply and collateral circulation. Am. J. Surg., 112(3): 337–347.
- Щепотин И.Б., Лукашенко А.В., Колесник Е.А. и др. (2011) Модификация реконструктивного этапа при панкреатодуоденальной резекции — методика физиологической реконструкции. Клин. онкол., 1(1): 30–34.
- Shchepotin I.B., Lukashenko A.V., Rozumii D.A. et al. (2011) The method of the isolated reconstruction by gastropancreatoduodenal resection. Khirurgiia, 10: 30–34.
- Shchepotin I.B., Lukashenko A.V., Kolesnik O.O. et al. (2012) Alternative Roux-en-Y Reconstruction After Pancreati-coduodenectomy. Eur. J. Surg. Oncol., 38(9): 851.
- Щепотін І.Б., Лукашенко А.В., Колеснік О.О. та ін. (2012) Спосіб формування панкреатоєюноанастомозу при хірургічному лікуванні хворих на злоякісні пухлини головки підшлункової залози. Бюл. № 3. Пат. № 67345 (u2011 11563 30.09.11 ).
- Щепотін І.Б., Лукашенко А.В., Колеснік О.О. та ін. (2012) Спосіб формування панкреатоєюноанастомозу при хірургічному лікуванні хворих на злоякісні пухлини головки підшлункової залози та пухлини періампулярної зони. Бюл, № 3. Пат. № 67346 (u2011 11564 30.09.11 Бюл. № 3 від10.02.12).
- Bassi C., Falconi M., Molinari E. et al. (2003) Duct-to-mucosa versus end-to-side pancreaticojejunostomy reconstruction after pancreaticoduodenectomy: results of a prospective randomized trial. Surgery, 134(5): 766–771.
- Bassi C., Dervenis C., Butturini G. et al. (2005) Postoperative pancreatic fistula: an international study group (ISGPF) definition. Surgery, 138(1): 8–13.
- Becker W.F. (1957) Pancreatoduodenectomy for carcinoma of the pancreas in an infant: report of a case. Ann. Surg., 145(6): 864–870; discussions 870–862.
- Rich R.H., Weber J.L., Shandling B. (1986) Adenocarcinoma of the pancreas in a neonate managed by pancreatoduodenectomy. J. Pediatr. Surg., 21(9): 806–808.
- Dasgupta R., Kim P.C. (2005) Relationship between surgical volume and clinical outcome: should pediatric surgeons be doing pancreaticoduodenectomies? J. Pediatr. Surg., 40(5): 793–796.
- Sugito K., Furuya T., Kaneda H. et al. (2012) Long-term follow-up of nutritional status, pancreatic function, and morphological changes of the pancreatic remnant after pancreatic tumor resection in children. Pancreas, 41(4): 554–559.
- Speer A.L., Barthel E.R., Patel M.M. et al. (2012) Solid pseudopapillary tumor of the pancreas: a single-institution 20-year series of pediatric patients. J. Pediatr. Surg., 47(6): 1217–1222.
- Andiran F., Tanyel F.C., Kale G. et al. (1997) Obstructive jaundice resulting from adenocarcinoma of the ampulla of Vater in an 11-year-old boy. J. Pediatr. Surg., 32(4): 636–637.
- Saunders J., Ballantyne G.H., Belsley S. et al. (2008) One-year readmission rates at a high volume bariatric surgery center: laparoscopic adjustable gastric banding, laparoscopic gastric bypass, and vertical banded gastroplasty-Roux-en-Y gastric bypass. Obes. Surg., 18(10): 1233–1240.
- Saluja A., Saluja M., Villa A. et al. (1989) Pancreatic duct obstruction in rabbits causes digestive zymogen and lysosomal enzyme colocalization. J. Clin. Invest., 84(4): 1260–1266.
- Armstrong C.P., Taylor T.V., Torrance H.B. (1985) Pressure, volume and the pancreas. Gut, 26(6): 615–624.
- Wang G.J., Gao C.F., Wei D. et al. (2009) Acute pancreatitis: etiology and common pathogenesis. World J. Gastroenterol.: WJG, 15(12): 1427–1430.
- Pescio G., Cariati E. (1996) A new reconstructive method after pancreaticoduodenectomy: the triple Roux on a «P» loop. Rationale and radionuclide scanning evaluation. HPB surgery: a world journal of hepatic, pancreatic and biliary surgery, 9(4): 223–227.
- Klaus A., Hinder R.A., Nguyen J.H. et al. (2003) Small bowel transit and gastric emptying after biliodigestive anastomosis using the uncut jejunal loop. Am. J. Surg., 186(6): 747–751.
- Faircloth A.C., Noble J. (2012) Anesthetic management of a pediatric patient undergoing a pancreatoduodenectomy with portal vein reconstruction. AANA J., 80(1): 37–42.
- Reichman T.W., Anthony T., Testa G. (2011) Treatment of extrahepatic portal hypertension following a whipple procedure with a Rex shunt: report of a case. Surgery today, 41(2): 292–296.
- Muller C.O., Guerin F., Goldzmidt D. et al. (2012) Pancreatic resections for solid or cystic pancreatic masses in children. J. Pediatr. Gastroenterol. Nutr., 54(3): 369–373.
- Shorter N.A., Glick R.D., Klimstra D.S. et al. (2002) Malignant pancreatic tumors in childhood and adolescence: The Memorial Sloan-Kettering experience, 1967 to present. J. Pediatr. Surg., 37(6): 887–892.
- van Berge Henegouwen M.I., Moojen T.M., van Gulik T.M. et al. (1998) Postoperative weight gain after standard Whipple’s procedure versus pylorus-preserving pancreatoduodenectomy: the influence of tumour status. Br. J. Surg., 85(7): 922–926.
- Lemaire E., O’Toole D., Sauvanet A. et al. (2000) Functional and morphological changes in the pancreatic remnant following pancreaticoduodenectomy with pancreaticogastric anastomosis. Br. J. Surg., 87(4): 434–438.
- Tocchi A., Mazzoni G., Liotta G. et al. (2001) Late development of bile duct cancer in patients who had biliary-enteric drainage for benign disease: a follow-up study of more than 1,000 patients. Ann. Surg., 234(2): 210–214.
- Birkmeyer J.D., Siewers A.E., Finlayson E.V. et al. (2002) Hospital volume and surgical mortality in the United States. N. Engl. J. Med., 346(15): 1128–1137.
- Ohata R., Okazaki T., Ishizaki Y. et al. (2010) Pancreaticoduodenectomy for pancreatoblastoma: a case report and literature review. Pediatr. Surg. Int., 26(4): 447–450.
- Yaacobi E., Steiner Z., Ashkenazi I. et al. (2010) Solid pseudopapillary tumor of the pancreas: raising awareness of a not so rare pancreatic tumor affecting young females. Eur. J. Pediatr. Surg.: official journal of Austrian Association of Pediatric Surgery [et al.] = Zeitschrift fur Kinderchirurgie, 20(1): 62–65.
- Marwan A., Christein J.D. (2009) Malignant Nonfunctioning Neuroendocrine Neoplasm of the Pancreas in a 10-Year-Old Child. Case reports in gastroenterology, 3(1): 92–96.
- Jung S.E., Kim D.Y., Park K.W. et al. (1999) Solid and papillary epithelial neoplasm of the pancreas in children. World J. Surg., 23(3): 233–236.
- Shamberger R.C., Hendren W.H., Leichtner A.M. (1994) Long-term nutritional and metabolic consequences of pancreaticoduodenectomy in children. Surgery, 115(3): 382–388.
- Newman K., Vates T., Duffy L. et al. (1992) Pancreatoduodenectomy with preservation of the stomach and pylorus: a safe and effective alternative in children. J. Pediatr. Surg., 27(10): 1334–1335.
- Kaufman S.L., Reddick R.L., Stiegel M. et al. (1986) Papillary cystic neoplasm of the pancreas: a curable pancreatic tumor. World J. Surg., 10(5): 851–859.
- Taxy J.B. (1976) Adenocarcinoma of the pancreas in childhood. Report of a case and a review of the English language literature. Cancer, 37(3): 1508–1518.
- Mah P.T., Loo D.C., Tock E.P. (1974) Pancreatic acinar cell carcinoma in childhood. Am. J. Dis. Child., 128(1): 101–104.
- Grosfeld J.L., Clatworthy H.W., Jr., Hamoudi A.B. (1970) Pancreatic malignancy in children. Arch. Surg., 101(3): 370–375.
- Fonkalsrud E.W., Wilkerson J.A., Longmire W.P. Jr. (1966) Pancreatoduodenectomy for islet-cell tumor of the pancreas in infancy and childhood. Case report with five-year survival. JAMA: J. Am. Med. Ass., 197(7): 586–588.
- Gu W.Z., Zou C.C., Zhao Z.Y. et al. (2008) Childhood pancreatoblastoma: clinical features and immunohistochemistry analysis. Cancer letters, 264(1): 119–126.
- Cao L., Liu D. (2007) Diagnosis and treatment of pancreatoblastoma in China. Pancreas, 34(1): 92–95.
- Defachelles A.S., Martin De Lassalle E., Boutard P. et al. (2001) Pancreatoblastoma in childhood: clinical course and therapeutic management of seven patients. Med. Pediatr. Oncol., 37(1): 47–52.
- Vossen S., Goretzki P.E., Goebel U. et al. (1998) Therapeutic management of rare malignant pancreatic tumors in children. World J. Surg., 22(8): 879–882.
- Jaubertdebeaujeu M., Chabal J., Metais B. et al. (1964) Duodeno-Cephalic Pancreatectomy for Pancreatic Tumor in a 4 1/2 Year-Old Child. Pediatrie, 19: 369–373.














Leave a comment