Еволюція сфінктерзберігаючої хірургії у хворих на рак нижньоампулярного відділу прямої кишки
Щепотин И.Б.1, Колесник Е.А.1, Приймак В.В.1, Безносенко А.П.1, Яцина А.И.1, Ерко И.П. 2, Балабушко С.Б.1
Резюме. Проведено порівняльний аналіз ефективності різних видів сфінктерзберігаючих оперативних втручань при лікуванні 205 хворих на рак нижньоампулярного відділу прямої кишки залежно від методу реконструкції кишечнику. Доведено переваги проктектомії з формуванням анастомозу за розробленою в клініці методикою та низьких передніх резекцій прямої кишки з формуванням колоректальних степлерних анастомозів перед стандартними черевно-анальними резекціями щодо поліпшення безпосередніх і функціональних результатів лікування, а також якості життя хворих.
Резюме. Проведен сравнительный анализ эффективности различных видов сфинктерсохраняющих оперативных вмешательств при лечении 205 больных раком нижнеампулярного отдела прямой кишки в зависимости от метода реконструкции кишечника. Доказано преимущество проктэктомии с формированием анастомоза по разработанной в клинике методике и низких передних резекций прямой кишки с формированием колоректальных степлерных анастомозов в сравнении со стандартными брюшно-анальными резекциями в отношении улучшения непосредственных и функциональных результатов лечения, а также качества жизни больных

Актуальность
Проблема хирургического лечения больных раком нижнеампулярного отдела прямой кишки (н/а РПК) остается одной из наиболее дискутабельных в онкологии, что обусловлено значительными темпами прироста заболеваемости, высокой частотой локорегионарных рецидивов, стабильно низкой выживаемостью, сложностями психосоциальной и трудовой реабилитации пациентов [1, 2, 5, 13, 18]. По данным Национального канцер-регистра, в течение последних 15 лет заболеваемость раком прямой кишки (РПК) в Украине возросла на 18%, а смертность — на 12,4%. Грубый показатель заболеваемости в 2010 г. составил 20,2 на 100 тыс. населения, а смертности — 12,1 соответственно. В структуре онкологической заболеваемости РПК занимает 5-е место среди мужского населения и 7-е — среди женского, а в структуре смертности выходит на 4-е место в обеих группах. Летальность до года в 2010 г. составляла 31,9% и остается практически без изменений с 2001 г. [4]. В то же время в США летальность до года не превышает 18%. Общая 5-летняя выживаемость больных РПК в Украине не превышает 31%; в США данный показатель составляет 69% с тенденцией к его повышению на 2,5% каждые 5 лет, на что повлияли главным образом изменения в технике оперативных вмешательств, более широкое использование предоперационной лучевой терапии и мультимодальный подход в выборе тактики лечения больных [4, 8, 13, 14].
В 60–65% случаев аденокарцинома прямой кишки (ПК) локализируется в дистальном, а более чем в 35% — в нижнеампулярном отделе [1, 3, 5, 11].
Хирургический метод является основным в лечении пациентов с данной нозологической формой. За последние годы в хирургии дистального РПК произошли революционные изменения в сторону значительного увеличения удельного веса сфинктерсохраняющих операций (ССО), что обусловлено совершенствованием техники оперативных вмешательств, внедрением методики тотальной мезоректумэктомии (ТМЭ), широким использованием в клинической практике механических степлеров при формировании низких колоректальных и колоанальных анастомозов, а также рутинным использованием неоадъювантной лучевой терапии [5, 6, 12, 18].
Накопление и усовершенствование знаний о биологии РПК, а именно о закономерностях дистального интрамурального распространения, привело к полному отрицанию «правила 5 см» для дистальной границы резекции у данной категории пациентов [1–3, 5, 12, 13]. Согласно современным тенденциям, онкологически адекватным у больных с дистальным РПК является достижение отрицательной границы резекции (R0) [5, 12, 13, 18]. Таким образом, брюшно-промежностная экстирпация ПК утратила статус «золотого стандарта» в хирургическом лечении больных н/а РПК, уступив место функционально выгодным ССО [1, 3, 15, 18].
На современном этапе развития медицины онкологическая целесообразность ССО в лечении больных н/а РПК уже не является предметом для дискуссии, а представлена стойкой клинической парадигмой [2, 5, 8, 10, 12]. Вместе с тем к хирургическому методу лечения выдвигаются требования обеспечить не только удовлетворительные онкологические, но и функциональные результаты лечения, а также приемлемый уровень качества жизни, что достигается путем максимально возможного сохранения морфологической целостности и функциональной полноценности сфинктерного аппарата прямой кишки (САПК) [6, 9, 12, 17]. В то время как объем и уровень резекции ПК регламентирован онкологической радикальностью, на функциональные результаты лечения влияют многие факторы, среди которых методика реконструктивного этапа занимает важное место [5, 6, 9, 13, 16].
На сегодня существуют три основных варианта ССО в хирургии н/а РПК: аппаратная низкая передняя резекция (НПР), проктэктомия (ПЭ) (интерсфинктерная резекция) и брюшно-анальная резекция ПК (БАР ПК) с низведением ободочной кишки на промежность с избытком в различных модификациях. Кардинальным отличием данных оперативних вмешательств является методика реконструктивного этапа. В странах с развитой экономикой операциями выбора в лечении больных н/а РПК являются аппаратная НПР и ПЭ [8–10, 18], однако в Украине и на постсоветском пространстве в целом БАР ПК — все еще самый популярный вид ССО для данной категории пациентов [1–3]. Согласно данными литературы, абластичность этих видов оперативных вмешательств идентична, так как радикальность операции задается основным резекционным этапом — ТМЭ, но функциональные результаты достаточно противоречивы и неоднозначны [5, 6, 9, 10, 16]. Представители разных хирургических школ постулируют приоритетность выполнения того либо иного вида оперативного вмешательства и демонстрируют преимущества авторского подхода, особенно в отношении непосредственных и функциональных результатов лечения [1, 3, 9, 17]. При этом, на наш взгляд, оценка функциональных результатов в большинстве исследований часто недостаточно информативна и объективна, поскольку не содержит адекватно и однозначно трактуемых конечных данных, оцененных с помощью легитимных, стандартных, специальных инструментов. Так, часто используют условные понятия («хорошо», «удовлетворительно», «плохо»), приводят данные авторских или других нелегитимных и маловалидных опросников [1, 3, 8, 9]. Таким образом, возникает настоятельная необходимость в проведении сравнительного анализа эффективности трех видов ССО у больных н/а РПК. Использование современных, объективных и легитимных инструментов предназначено для минимизации ошибок при оценке функциональных результатов лечения.
Цель исследования — повысить эффективность лечения больных н/а РПК и улучшить качество их жизни путем усовершенствования методик ССО.
Материалы и методы исследования
Проведен комплексный анализ результатов выполнения ССО у 205 больных н/а РПК T2–4N0–2M0. Среди них мужчин — 119 (58,1%), женщин — 86 (41,9%). Средний возраст исследуемого контингента составил 60,9 года и колебался в диапазоне от 24 до 81 года. Более 87% пациентов были в возрасте старше 50 лет. Для адекватного стадирования использовали стандартный комплекс диагностических исследований, в том числе магнитно-резонансную томографию малого таза, трансректальное ультразвуковое исследование, компьютерную томографию. Пациенты получали неоадъювантную лучевую терапию согласно стандартам; всем выполняли ТМЭ.
Сравнительный анализ хирургического лечения у пациентов с н/а РПК проведен в зависимости от способа реконструкции кишечника: группа I — 65 больных, у которых выполнена ПЭ с формированием ручного колоперианального анастомоза по разработанной в клинике методике, дивертивную стому для протекции анастомоза не использовали; группа II — 65 больных, у которых проведена аппаратная НПР ПК с формированием степлерного колоректального анастомоза и дивертивной илеостомы (81,5%) (закрытие илеостомы проводили через 2 мес при отсутствии клинико-инструментальных и радиологических данных о несостоятельности анастомоза); группа III — 75 пациентов, которым выполнено БАР ПК с низведением ободочной кишки на промежность с избытком и формированием ручного колоректального или колоанального анастомоза в два этапа эвагинационным методом. Учитывая тот факт, что выраженность функциональных нарушений после низких ректальных резекций обратно пропорциональна высоте формирования анастомоза над зубчатой линией, для адекватности дальнейшего межгруппового сравнения функциональных результатов и качества жизни больных гетерогенная группа III была разделена по высоте формирования анастомоза на группу IIIА (колоректальный анастомоз, операция типа Турнбула, эквивалентно НПР ПК) и группу IIIВ (колоанальный анастомоз, операция типа Нисневича — Петрова — Холдина, эквивалентно ПЭ). Схематическое изображение уровня резекции ПК и методики реконструкции кишечника представлено на рис. 1.
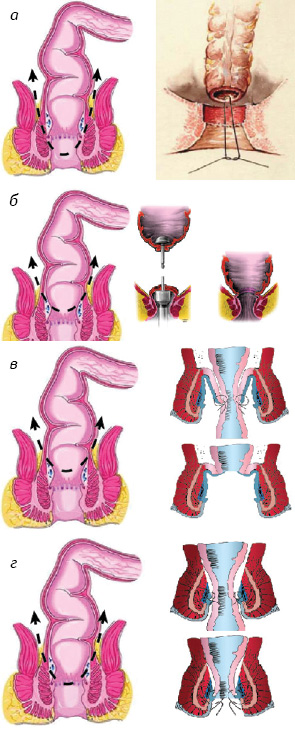
Оценку функциональных результатов проводили с помощью опросника FISI (Fecal Incontinence Severity Index). Для дополнительной объективизации оценки использовали непрерывную инфузионную анальную профилометрию с целью определения давления в анальном канале и сфинктероампуломанометрию для оценки состояния нервно-рефлекторной дуги неоректума и САПК. Качество жизни оценивали с помощью специализированного опросника FIQL (Fecal Incontinence Quality of Life). Для обеспечения доказательности исследования проведены его планирование, обоснование статистических методов и формирование групп в соответствии с поставленными задачами. Статистический анализ проводили с использованием пакета программ Stata 12. Средний срок наблюдения больных составил 39,2 мес (16–64,2 мес). Группы репрезентативны по возрасту, полу, распространенности онкологического процесса и основными прогностическими факторами. Характеристика больных представлена в табл. 1.
Таблица 1. Характеристика групп пациентов
| Группы | I | II | III | p value |
| Пол | >0,05 | |||
| мужской | 35 (53,8%) | 31 (47,7%) | 53 (70,7%) | – |
| женский | 30 (46,2%) | 34 (52,3%) | 22 (29,3%) | – |
| Средний возраст(Х+σ) | 60,1±11,2 | 58,8±10,1 | 61,3±9,3 | >0,05 |
| Высота опухоли от линии Хилтона, см, (Х+σ) | 3,05 ±1,0 | 5,2±0,8 | 4,1±1,1 | |
| Опухоли высотой72,5%4,6%32% |
Результаты и их обсуждение
При изучении непосредственных результатов лечения выявлено: послеоперационные осложнения в группе I наблюдались у 3 больных (4,6%) и представлены распространенным некрозом низведенной кишки, что послужило поводом к формированию по 1 случаю илеостомы, трансверзостомы и экстирпации низведенной кишки.
В группе II у 7 больных (10,7%) диагностирована несостоятельность анастомоза с развитием наружных каловых свищей. Среди них в 3 случаях (4,6%) осложнения ликвидированы консервативными методами, у всех больных дивертивная илеостома закрыта в течение 7 мес. В остальных 4 случаях (6,2%) для заживления дефекта в анастомозе в разные сроки после операции сформирована трансверзостома. Необходимо отметить, что в последних случаях превентивная илестома в реконструкции кишечника не использовалась. При хронологическом анализе этих оперативных вмешательств установлено, что у 3 больных операции были выполнены в 2008 г. на этапах освоения методики. Данный факт красноречиво подтверждает необходимость рутинного формирования дивертивной кишечной стомы после НПР ПК.
В группе III осложнения отмечены у 9 больных (12%). Некроз низведенной кишки зарегистрирован в 6 случаях (8%): у 1 пациента (1,3%) выявлено терминальный некроз и проведено консервативное лечение, у 2 больных (2,7%) сформировано трансверзостому, еще в 2 случаях (2,7%) выполнено ренизведение проксимальных отделов ободочной кишки и у 1 больного (1,3%) проведено экстирпацию низведенной кишки. Несостоятельность отсроченного анастомоза выявлена в 1 случае (1,3%), что потребовало формирования трансверзостомы. Послеоперационной летальности в исследуемых группах не было.
Хотя группы I и II демонстрируют лучшие результаты лечения, по сравнению с группой III, статистически значимой разницы в частоте послеоперационных осложнений между группами исследования не выявлено (р>0,05).
Таким образом, самым частым видом послеоперационных осложнений были некроз низведенной кишки в группах I и III и несостоятельность анастомоза в группе II. Учитывая тот факт, что несостоятельность анастомоза обусловлена некротическими изменениями анастомозированных сегментов желудочно-кишечного тракта, этиопатогенетически целесообразно объединить эти два вида осложнений в один — осложнения, связанные с нарушением трофики трансплантата. Данный вид послеоперационных осложнений является доминирующим в исследуемых группах: в группе I — в 3 случаях (4,6%), в группе II — в 7 (10,8%) и в группе III— в 7 (9,3%).
В нашем исследовании средняя продолжительность послеоперационного койко-дня составила 12,9 (10–27 койко-дней) в группе I; 11,7 (9–34) — в группе II и 17,3 (14–36) в группе III. Статистически значимое (p<0,05) сокращение продолжительности послеоперационного койко-дня в группах I и II обусловлено методикой реконструктивного этапа операции с неотложным формированием анастомоза. В отличие от этого, в группе III использовали методику отсроченного формирования анастомоза в 2 этапа, что закономерно приводит к увеличению продолжительности пребывания больных в стационаре.
При анализе ближайших и отдаленных результатов лечения в группах сравнения установлено, что в исследовании отсутствует статистически значимая разница показателей общей и безрецидивной кумулятивной выживаемости (р>0,05). Данный факт объясняется применением единой для всех трех групп стандартной техники хирургического вмешательства — ТМЭ. Так, показатель 3-летней общей и безрецидивной выживаемости в группе I составил 79,5 и 66,1%, в группе II — 81,5 и 66,6%, а в группе III — 77,9 и 68% соответственно (рис. 2, 3). Частота локорегионарных рецидивов: в группе I — 6 случаев (10,9%), в группе II — 6 случаев (10,9%), в группе III — 10 случаев (13,3%) (р>0,05).
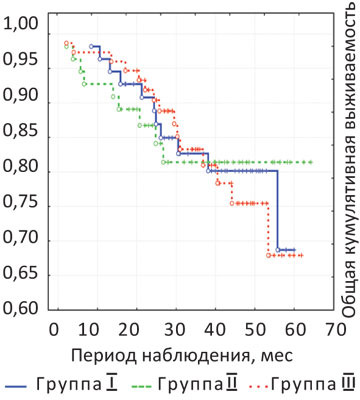
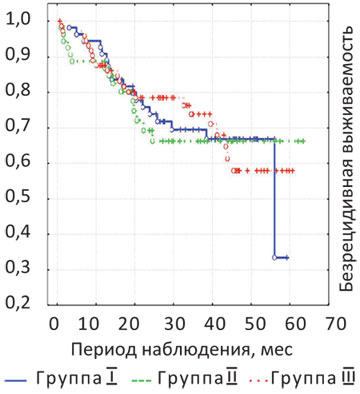
Частота послеоперационных осложнений, приведенных в исследовании, не превышала таковые в других источниках литературы. По данным зарубежной литературы, частота несостоятельности анастомоза после НПР ПК составляет от 5 до 23% [6–10, 12, 15]. Так, E. Stratilatovas и соавторы [17] изучали результаты лечения 82 больных после НПР ПК. Частота послеоперационных осложнений составляла 34,4% (11 больных), среди них несостоятельность анастомоза возникла в 5 случаях (15,6%). В течение 3 лет рецидивы развились у 4 больных (4,9%). Общая 3-летняя выживаемость составила 79%.
В исследовании V. Fazio и соавторов [7] были проанализированы результаты НПР ПК с формированием колоанальных анастомозов у 364 больных. Высота опухоли над уровнем зубчатой линии составила 3,5 см (2–5,5 см). Дивертивная илеостома использовалась у всех больных, закрывалась через 3 мес. Общее количество осложнений в исследовании составило 32%. Несостоятельность анастомоза отмечали в 10,2% случаев.
Согласно данным системного обзора S. Martin и соавторов [13] по результатам интерсфинктерной резекции ПК, частота R0-резекции составила 97%, частота формирования дивертивной илеостомы — 93,1%, средняя послеоперационная летальность — 0,8% (0–6%), послеоперационные осложнения — 25,8%, несостоятельность анастомоза — 9,1%, каловые свищи — 2,2%, септические осложнения в полости таза — 2,4%. При медиане наблюдения в 56 мес частота локальных рецидивов равнялась 6,7% (0–23%), 5-летняя общая выживаемость — 86,3% (62–97%), безрецидивная выживаемость — 78,6% (69–87%).
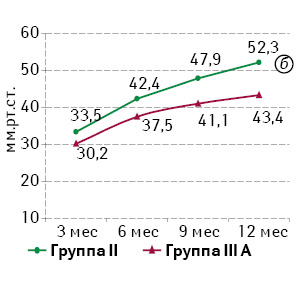
Учитывая оригинальность исследования, большое внимание уделяли обеспечению максимально объективной оценки функциональных результатов и качества жизни в исследуемых группах как комплексным современным показателям социальной адаптации. При анализе функциональных результатов с помощью шкалы FISI определялась устойчивая тенденция к улучшению показателей в течение года после операции во всех группах исследования, наиболее выраженная динамика — в группе II. При попарном межгрупповом сравнении эквивалентных групп выявлено веские статистически значимые преимущества групп ПЭ и НПР ПК перед эквивалентными группами БАР ПК (p<0,01). Динамика показателей приведена в табл. 2 и 3.
Таблица 2. Степень анальной инконтиненции согласно опроснику FISI в группе ПЭ и БАР ПК (группа IIIВ), (Х±σ)
| Группы | FISI | |||
| 3 мес | 6 мес | 9 мес | 12 мес | |
| Группа I | 55,5±3,6 | 48,5±6,4 | 46,5±8,4 | 43,0±9,9 |
| Группа IIIВ | 60,2±1,0 | 59,2±2,2 | 57,7±5,0 | 56,5±6,2 |
| рI–IIIВ | 0,0001 | 0,0001 | 0,0001 | 0,0001 |
Таблица 3. Степень анальной инконтиненции согласно опроснику FISI в группе НПР ПК и БАР ПК (группа IIIА), (Х±σ)
| Группы | FISI | |||
| 3 мес | 6 мес | 9 мес | 12 мес | |
| Группа II | 53,6±4,5 | 41,9±7,3 | 31,8±7,1 | 30,8±7,5 |
| Группа IIIА | 58,6±2,0 | 54,7±7,4 | 51,2±7,7 | 47,0±6,5 |
| рII–IIIА | 0,0001 | 0,0001 | 0,0001 | 0,0001 |
Анализ результатов, полученных при проведении профилометрии, также подтвердил устойчивую тенденцию к повышению базального тонуса и волевой сократительной активности САПК в течение года. Статистический анализ показателей базального и волевого тонуса САПК при сопоставлении эквивалентных групп продемонстрировал достоверно более низкие значения в группах IIIА и IIIВ по сравнению с группами II и I соответственно (р0,05). Наиболее выраженное отличие в полученных результатах отмечали между группами I и IIIВ. Динамика показателей отражена на рис. 4.
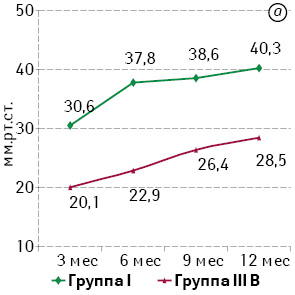
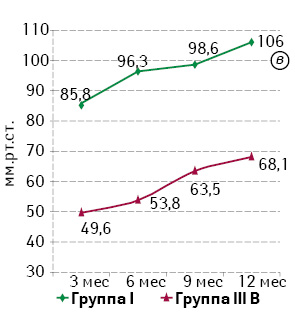
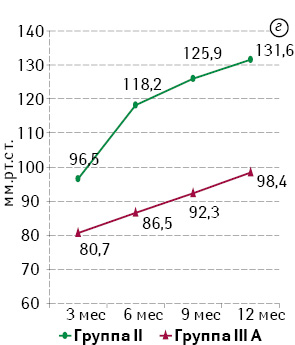
При анализе показателей длины функционального анального канала между группами сравнения не выявлено статистически значимой разницы (р>0,05), что подтверждает адекватность межгруппового сравнения по объему резекции ПК.
На основании результатов сфинктероампуломанометрии относительно базального тонуса и давления при волевом сокращении в анальном канале выявлено такую же закономерность, как и при анализе данных профилометрии, а именно: повышение тонуса в течение года после операции; статистически достоверное преимущество групп I и II перед группами IIIА и IIIВ соответственно (р<0,01), за исключением показателя базального тонуса на 3-м месяце наблюдения в группах II и IIIА (р=0,158).
При анализе показателей FIQL выявлено статистически значимое преимущество в качестве жизни групп I и II над эквивалентными группами IІІА и IIIВ по всем шкалам опросника (р<0,01), а также улучшение показателей в динамике (рис. 5).
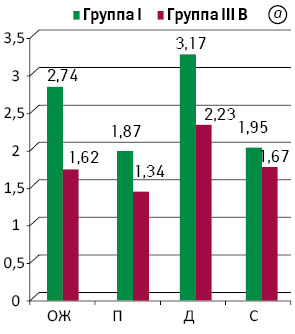
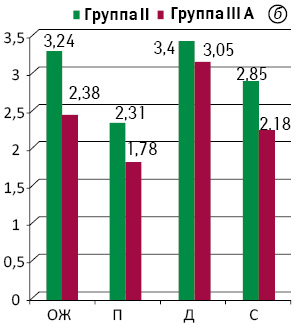
Вышеуказанные функциональные преимущества групп I и II перед группами IIIА и IIIВ соответственно объясняем снижением функционального резерва САПК при БАР ПК вследствие использования эвагинационного этапа операции и длительного пребывания отечной, воспалительной низведенной кишки в анальном канале. Преобладание групп I и II над группами IIIА и IIIВ в отношении функциональных результатов лечения и качества жизни свидетельствуют о том, что на уровень анальной континенции влияет не столько остаточный объем ПК или неоректума, сколько снижение функционального резерва САПК в результате его механического повреждения во время операции либо после нее. Эти данные совпадают с результатами исследования E.С. Jehle и Т. Haehnel, которые свидетельствуют об отсутствии корреляции между уровнем анастомоза и манометрическими показателями функции САПК, а также между уровнем анастомоза и частотой дефекации. Авторы постулируют, что аноректальная функция после НПР ПК обусловлена не остаточной длиной ПК, а хирургической травмой САПК и нарушением его иннервации [10].
Эволюция хирургического лечения больных н/а РПК предполагает постоянную селекцию более эффективных методик. Революционным прорывом в лечении пациентов с РПК стало внедрение методики ТМЭ и неоадъювантной лучевой терапии. Именно использование ТМЭ с сохранением вегетативной автономной системы таза позволило получить наилучшие непосредственные, функциональные и отдаленные результаты лечения [5–9, 14, 17, 18]. Остается дискутабельным вопрос выраженности функциональных нарушений после низких передних и интерсфинктерных резекций ПК с различными видами реконструкции кишечника [3, 5, 9, 12]. Только данные, полученные после тщательного, обширного научного анализа, позволят провести переоценку подходов к использованию различных видов ССО в хирургии н/а РПК.
Выводы
Метод реконструкции кишечника после ССО при н/а РПК является независимым прогностическим фактором выраженности функциональных нарушений и снижения качества жизни больных.
Группы ПЭ и НПР ПК демонстрируют весомые статистически значимые преимущества перед эквивалентными группами БАР ПК в отношении функциональных результатов лечения (p<0,01), что регламентирует приоритетность их использования в хирургическом лечении больных н/а РПК.
Качество жизни больных после ПЭ и НПР ПК статистически значимо лучше по сравнению с эквивалентными группами БАР ПК (p<0,01).
При аппаратной НПР у больных н/а РПК реконструкцию кишечника необходимо рутинно дополнять дивертивной кишечной стомой, что позволяет уменьшить количество послеоперационных осложнений, ускорить реабилитацию и снизить материально-экономические затраты на лечение больных.
Результаты исследования демонстрируют, что на современном этапе развития онкологии НПР ПК и ПЭ являются операциями выбора в хирургии н/а РПК благодаря обеспечению лучших функциональных результатов лечения и лучшего качества жизни больных.
Список использованной литературы
- Бондарь Г.В., Башеев В.Х., Думанский Ю.В. (2009) Успехи и проблемы лечения рака прямой кишки. Новоутворення, 3–4: 19–24.
- Воробьев Г.И., Шелыгин Ю.А., Еропкин П.В. и др. (2008) Проктэктомия с сохранением элементов наружного сфинктера в хирургии нижнеампулярного рака прямой кишки. Хирургия, 9: 8–14.
- Пикунов Д.Ю., Кашников В.Н., Джанаев Ю.А., Рыбаков Е.Г. (2011) Отдаленные результаты сохранения элементов наружного сфинктера при нижнеампулярном раке прямой кишки. Клиническая онкология, 1: 43–46.
- Рак в Україні, 2010–2011. Захворюваність, смертність, показники діяльності онкологічної служби. (2012) Бюл. Нац. канцер-реєстру України. Київ, 13: 124 с.
- Щепотін І.Б., Колесник О.О., Приймак В.В. та ін. (2010) Оптимізація хірургічного лікування хворих на рак дистального відділу прямої кишки. Онкологія, 12(2): 70–72.
- Enker W.E. (1997) Total mesorectal excision — the new golden standard of surgery for rectal cancer. Ann. Med., 29(2): 127–133.
- Fazio V.W., Zutshi M., Remzi F.H. et al. (2007) A randomized multicenter tiral to compare long–term functional outcome, quality of life, and complications of surgical procedures for low rectal cancer. Ann. Surg., 246(3): 481–490.
- Heald R.J., Moran B.J., Ryall R.D. et al. (1998) Rectal cancer: the Basingstoke experience of total mesorectal excision, 1978–1997. Arch. Surg., 133: 894–899.
- Ito V., Saito N., Sugito M. et al. (2009) Analysis of clinical factors associated with anal function after intersphincteric resection for very low rectal cancer Dis. Colon. Rectum, 52(1): 64–70.
- Jehle E.C., Haehnel T., Starlinger M.J., Becker H.D. (1995) Level of the anastomosis does not influence functional outcome after anterior rectal resection for rectal cancer. Am. J. Surg., 169(1): 147–152.
- Jemal A., Siegel R.,Ward E. et al. (2009) Cancer statistics, 2009. CA Cancer J. Clin., 59(4): 225–249.
- Leo E., Belli F., Andreola S. et al. (2000) Total rectal resection and complete mesorectum excision followed by coloanal anastomosis as the optimal treatment for low rectal cancer: the experience of the National Cancer Institute of Milan. Ann. Surg. Oncol., 7: 125–132.
- Martin S.T., Heneghan H.M., Winter D.C. (2012) Systematic review of outcomes after intersphincteric resection for low rectal cancer. Brit. J. Surg., 99(5): 603–612.
- Murphy J., Hammond T.M., Knowles C.H. et al. (2007) Does anastomotic technique infuence anorectal function after sphincter–saving rectal cancer resection? A systematic review of evidence rom randomized trials. J. Am. Coll. Surg., 204: 673–680.
- Rutkowski A., Bujko K., Nowacki M.P. et al. (2008) Distal Bowel Surgical Margin Shorter than 1 cm After Preoperative Radiation for Rectal Cancer: Is It Safe? Ann. Surg. Oncol., 3: 2014–2019.
- Saito N., Moriya Y., Shirouzu K., Maeda K. et al. (2006) Intersphincteric resection in patients with very low rectal cancer: a review of the Japanese. Dis. Colon Rectum; 49: 13–22.
- Stratilatovas E., Sangaila E., Sinkevičius Ž. et al. (2011) A randomized multicenter trial to compare functional outcome and complications of surgical procedures for low rectal cancers. Acta medica Lituanica; 18(1): 37–42.
- Tilney H.S., Tekkis P.P. (2007) Extending the horizons of restorative rectal surgery: intersphincteric resection for low rectal cancer. Colorectal Dis.; 10: 3–16.














Leave a comment